OVITRELLE 250 µg oldatos injekció előretöltött injekciós tollban
Hatóanyag:
choriogonadotropin alfa
Csak vényre kapható
Kiszerelés:
1x

Tájékoztató ár:
-
Normatív TB-támogatás:
5269
Eü. emelt támogatás:
Nem
-
Gyógyszerfőkategória:
GONADOTROPINOK ÉS MÁS OVULATIO-STIMULÁLÓK
-
Törzskönyvi szám:
EU/1/00/165/008
-
Gyógyszeralkategória:
Gonadotropinok
-
Gyártó:
Merck Europe
Betegtájékoztató
1. Milyen típusú gyógyszer az Ovitrelle és milyen betegségek esetén alkalmazható?
Milyen típusú gyógyszer az Ovitrelle?
Az Ovitrelle "alfa-koriogonadotropint" tartalmaz, amelyet laboratóriumi körülmények között, speciális rekombináns DNS technikával állítanak elő. Az alfa-koriogonadotropin az emberi szervezetben természetesen is megtalálható "koriogonadotropinnak" nevezett hormonhoz hasonlít, amely a szaporodásban és termékenységben játszik szerepet.
Milyen betegségek esetén alkalmazható az Ovitrelle?
Az Ovitrelle-t más gyógyszerekkel együtt alkalmazzák:
- Az asszisztált reprodukciós kezelésben (eljárás, amely elősegítheti, hogy teherbe essen), például "in vitro megtermékenyítésben" részt vevő nők esetében több tüsző fejlődését és érését elősegítendő. Először más gyógyszerek alkalmazásával több tüsző növekedését serkentik.
- Elősegítendő a petesejtek kiszabadulását a petefészekből (ovuláció-indukció) olyan nőknél is, akiknél nem termelődik petesejt (ezt az állapotot hívják anovulációnak), vagy akiknél túlságosan kevés petesejt képződik (oligo-ovuláció). Először más gyógyszereket adnak a tüszők kifejlődése és érése érdekében.
2. Tudnivalók az Ovitrelle alkalmazása előtt
Ne alkalmazza az Ovitrelle-t
- ha allergiás az alfa-koriogonadotropinra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
- ha hipotalamuszában vagy agyalapi mirigyében daganat van (mindkét szerv az agy része).
- ha Önnek petefészek-megnagyobbodása van, illetve folyadékot tartalmazó, ismeretlen eredetű tasakok (petefészekciszták) vannak a petefészkében.
- ha Önnek megmagyarázatlan hüvelyi vérzése van.
- ha Önnél petefészek-, méh- vagy emlőrákot mutattak ki.
- ha Önnek súlyosan gyulladtak a vénái vagy véralvadék van a vénáiban (aktív tromboembóliás megbetegedés).
- ha Önnél fennáll bármilyen olyan állapot, ami a normális terhességet általában lehetetlenné teszi, mint pl. menopauza vagy korai menopauza (petefészek-elégtelenség) vagy a nemi szervek torzulása.
Ne alkalmazza az Ovitrelle-t, ha a fentiek bármelyike érvényes Önre. Ha nem biztos ebben, a gyógyszer alkalmazása előtt kérdezze meg kezelőorvosát.
Figyelmeztetések és óvintézkedések
A kezelés kezdete előtt az Ön és partnere termékenységét meg kell vizsgálnia egy termékenységi problémák kezelésében járatos orvosnak.
Petefészektúlműködés -szindróma (OHSS)
Ez a gyógyszer fokozhatja az OHSS kialakulásának kockázatát. Ebben az esetben a tüszők túlfejlődnek és nagy cisztákká alakulnak.
Ha alhasi fájdalma van, gyorsan gyarapodik a testsúlya, hányingere van vagy hány, illetve nehezen lélegzik, ne adja be az Ovitrelle injekciót, és mielőbb beszéljen kezelőorvosával (lásd 4. pont). Ha OHSS alakul ki Önnél, utasíthatják, hogy legalább négy napig nem közösülhet, vagy pedig mechanikus fogamzásgátló módszert kell alkalmaznia.
Az OHSS kockázata azzal csökkenthető, hogy az Ovitrelle-t a szokásos dózisban alkalmazzák, és a teljes kezelési ciklus ideje alatt Önt gondosan ellenőrzik (pl. az ösztradiolszint ellenőrzése vérvizsgálattal, illetve ultrahangos vizsgálat).
Többes terhesség és/vagy születési rendellenességek
Az Ovitrelle alkalmazásakor nagyobb a kockázata az ugyanazon időben egynél több gyermekkel való terhességnek ("többes terhesség", általában ikrek), mint természetes úton való megtermékenyítéskor. A többes terhesség orvosi szövődményekhez vezethet az Ön és magzatai esetében. Az asszisztált reprodukciós kezelések alkalmazása esetén a többes terhesség kockázata az Ön életkorával, a visszaültetett megtermékenyített petesejtek vagy embriók minőségével és számával függ össze. A többes terhesség és a termékenységi problémákkal küzdő párok sajátos jellemzői (pl. életkor) ugyancsak összefüggést mutathatnak a születési rendellenességek megnövekedett lehetőségével.
A többes terhesség kockázata azzal csökkenthető, ha a teljes kezelési ciklus ideje alatt Önt gondosan ellenőrzik (pl. az ösztradiolszint ellenőrzése vérvizsgálattal, illetve ultrahangos vizsgálat).
Méhen kívüli terhesség
Méhen kívüli terhesség (ektópiás terhesség) fordulhat elő a méhkürt (ez szállítja a petesejtet a petefészektől a méhbe) károsodása esetén. Ezért kezelőorvosának korai ultrahangos vizsgálatot kell végeznie a méhen kívüli terhesség lehetőségének kizárása érdekében.
Vetélés
Az asszisztált reprodukciós kezelések alkalmazása vagy a petefészkeinek petesejttermelésre való serkentése esetén nagyobb a vetélés esélye, mint egy átlagos nő esetében.
Véralvadási problémák (tromboembóliás események)
Beszéljen kezelőorvosával az Ovitrelle alkalmazása előtt, ha Önnél vagy bármelyik családtagjánál valaha előfordult vérrög a láb vagy a tüdő ereiben, valamint ha szívroham vagy agyi érkatasztrófa (sztrók) fordult elő. Lehetséges, hogy Önnél nagyobb valószínűséggel alakulnak ki súlyos vérrögök vagy súlyosbodhatnak a már létező vérrögök az Ovitrelle-kezelés során.
A nemi szervek daganatos megbetegedései
Beszámoltak jóindulatú és rosszindulatú petefészekdaganatok, valamint egyéb, nemi szervi daganatok előfordulásáról olyan nők esetében, akik meddőség miatt többször estek át gyógyszeres kezelésen.
Terhességi tesztek
Ha az Ovitrelle alkalmazását követően, vagy legkésőbb tíz nappal később terhességi tesztet végez szérumból vagy vizeletből, előfordulhat, hogy hamisan pozitív eredményt kap. Ha bizonytalan, beszéljen kezelőorvosával.
Gyermekek és serdülők
Az Ovitrelle gyermekeknél és serdülőknél való alkalmazása nem releváns.
Egyéb gyógyszerek és az Ovitrelle
Feltétlenül tájékoztassa kezelőorvosát a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről.
Terhesség és szoptatás
Ha Ön terhes vagy szoptat, ne alkalmazzon Ovitrelle-t.
Ha Ön terhes vagy szoptat, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
Az Ovitrelle valószínűleg nem fogja befolyásolni a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeit.
Az Ovitrelle nátriumot tartalmaz
A készítmény kevesebb mint 1 mmol (23 mg) nátriumot tartalmaz adagonként, azaz gyakorlatilag "nátriummentes".
3. Hogyan kell alkalmazni az Ovitrelle-t?
A gyógyszert mindig a kezelőorvosa által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy gyógyszerészét.
Mennyit kell alkalmazni?
- A készítmény ajánlott adagja 1 db előretöltött injekciós tollban lévő mennyiség (250 mikrogramm/0,5 ml), egyszeri injekcióban beadva.
- Kezelőorvosa el fogja Önnek pontosan magyarázni, mikor kell beadni az injekciót.
A gyógyszer alkalmazása
- Ha önmagának adja az Ovitrelle injekciót, kérjük, figyelmesen olvassa el, és kövesse a dobozban levő "Használati utasítást".
- Az Ovitrelle injekció szubkután alkalmazásra való, vagyis a bőr alá kell beadni.
- Mindegyik előretöltött injekciós toll kizárólag egyszeri alkalmazásra való.
- A kezelőorvosa vagy a gondozását végző egészségügyi szakember megmutatja Önnek az Ovitrelle előretöltött injekciós toll alkalmazását - a gyógyszer befecskendezését.
- Az Ovitrelle befecskendezését a kezelőorvos vagy a gondozását végző egészségügyi szakember útmutatásai szerint végezze.
- Az injekció beadása után az injekciós tollat és használt tűt biztonságos módon (a tűt a tűvédőbe visszahelyezve) dobja ki.
Ha az előírtnál több Ovitrelle-t alkalmazott
Az Ovitrelle túladagolásának tünetei nem ismertek, bár petefészektúlműködés-szindróma (OHSS) kialakulhat (lásd még 4. pont).
Ha elfelejtette alkalmazni az Ovitrelle-t
Ha elfelejtette alkalmazni az Ovitrelle-t, azonnal keresse fel kezelőorvosát, amint ezt észleli.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Ha az alábbi súlyos mellékhatások bármelyikét észleli, hagyja abba az Ovitrelle alkalmazását és azonnal forduljon orvoshoz - sürgős orvosi kezelésre lehet szüksége:
- Allergiás reakciók, mint kiütés, gyors vagy egyenetlen pulzus, a nyelv és a torok duzzanata, tüsszentés, sípoló légzés, vagy súlyos légzési nehézségek - nagyon ritkák (10 000 betegből legfeljebb 1 beteget érinthet).
- Alhasi fájdalom, hasi puffadás vagy diszkomfortérzés és hányinger vagy hányás a petefészektúlműködés-szindróma (OHSS) tünetei lehetnek. Ez azt jelezheti, hogy a petefészkek túlzottan reagáltak a kezelésre és nagy petefészekciszták alakultak ki (lásd ugyancsak a 2. pontban, "Petefészektúlműködés-szindróma"). Ez az esemény gyakori (10 betegből legfeljebb 1 beteget érinthet).
- Az OHSS súlyossá válhat nagymértékben megnagyobbodott petefészkekkel, csökkent vizelettermeléssel, testsúlynövekedéssel, nehézlégzéssel és lehetséges folyadékfelhalmozódással a hasüregben vagy mellkasban. Ez az esemény nem gyakori (100 betegből legfeljebb 1 beteget érinthet).
- Súlyos vérrögképződéssel járó - néha OHSS-től függetlenül is fellépő - szövődmények (tromboembóliás események) nagyon ritkán fordulnak elő. Ez mellkasi fájdalmat, nehézlégzést, agyi érkatasztrófát (sztrókot) vagy szívinfarktust okozhat (lásd ugyancsak a 2. pontban, "Véralvadási problémák").
Egyéb mellékhatások
Gyakori (10 betegből legfeljebb 1 beteget érinthet)
- Fejfájás.
- Az injekció beadási helyén előforduló helyi reakciók, mint például fájdalom, kivörösödés vagy duzzanat.
Nem gyakori (100 betegből legfeljebb 1 beteget érinthet)
- Hasmenés.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy gyógyszerészét. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az alábbi elérhetőségek valamelyikén keresztül:
Nemzeti Népegészségügyi és Gyógyszerészeti Központ, Postafiók 450, H-1372 Budapest
honlap: www.ogyei.gov.hu
elektronikus bejelentő form: https://mellekhatas.ogyei.gov.hu/
e-mail: adr.box@ogyei.gov.hu
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell az Ovitrelle-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A címkén és a dobozon feltüntetett lejárati idő (EXP:) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Hűtőszekrényben (2 °C-8 °C) tárolandó. Nem fagyasztható!
Ne alkalmazza az Ovitrelle-t, ha a bomlás bármilyen jelét fedezi fel, ha a folyadék részecskéket tartalmaz vagy nem tiszta.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz az Ovitrelle?
- A készítmény hatóanyaga az alfa-koriogonadotropin, rekombináns DNS technikával előállítva.
- Mindegyik előretöltött injekciós toll 250 mikrogramm alfa-koriogonadotropint tartalmaz 0,5 ml-ben (körülbelül 6500 Nemzetközi Egységgel, NE, egyenértékű).
- Egyéb összetevők: mannit, metionin, dinátrium-foszfát-dihidrát, nátrium-dihidrogén-foszfát- monohidrát, poloxamer 188, foszforsav (a pH beállítására), nátrium-hidroxid (a pH beállítására) és injekcióhoz való víz.
Milyen az Ovitrelle külleme és mit tartalmaz a csomagolás?
- Az Ovitrelle tiszta, színtelen vagy halványsárga folyadék egy előretöltött injekciós tollban.
- Mindegyik injekciós toll 0,5 ml oldatot tartalmaz.
- 1 db előretöltött injekciós tollat és 2 db injekciós tűt (egy tartalék) tartalmazó csomagokban kerül forgalomba.
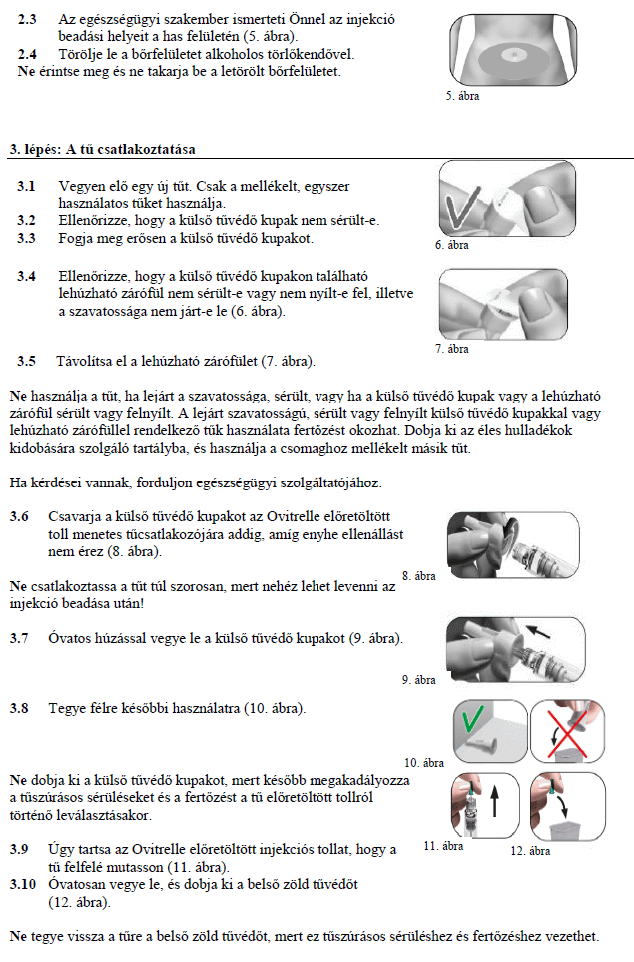
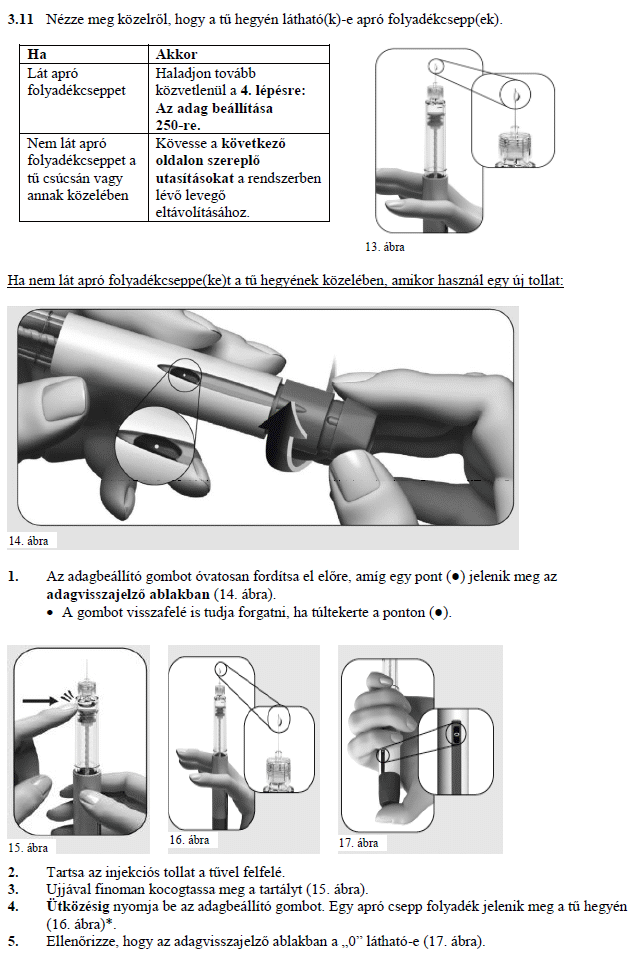
HASZNÁLATI UTASÍTÁS
Ovitrelle 250 mikrogramm
Oldatos injekció előretöltött injekciós tollban alfa-koriogonadotropin


 $$
$$
A szöveg publikálásának dátuma az ema.europa.eu weboldalon: 2023. 10. 04.
