REKOVELLE 12 µg/0,36 ml oldatos injekció előretöltött injekciós tollban
Hatóanyag:
follitropin delta
Csak vényre kapható
Kiszerelés:
1x+3x inj. tű

Tájékoztató ár:
-
Normatív TB-támogatás:
14194
Eü. emelt támogatás:
Nem
-
Gyógyszerfőkategória:
GONADOTROPINOK ÉS MÁS OVULATIO-STIMULÁLÓK
-
Törzskönyvi szám:
EU/1/16/1150/004
-
Gyógyszeralkategória:
Gonadotropinok
-
Gyártó:
Ferring Pharmaceuticals
Betegtájékoztató
1. Milyen típusú gyógyszer a REKOVELLE és milyen betegségek esetén alkalmazható?
A REKOVELLE egy tüszőserkentő hormont, delta-follitropint tartalmaz, amely a gonadotropin nevű hormonok családjába tartozik. A gonadotropinok a szaporodásban és a termékenységben játszanak szerepet.
A REKOVELLE-t női meddőség kezelésére alkalmazzák, és a teherbeesést elősegítő, úgynevezett asszisztált reprodukciós programokban, például lombikbébi-programban (in vitro fertilizáció, IVF) részt vevő, illetve intracitoplazmás spermiuminjekciós eljárással (ICSI) kezelt nőknél alkalmazzák. A REKOVELLE serkenti a petefészkeket, így azokban több petezsák ("tüsző") indul növekedésnek és érik meg, amelyekből aztán leszívják a petesejteket, és laboratóriumban megtermékenyítik.
2. Tudnivalók a REKOVELLE alkalmazása előtt
Mielőtt elkezdené a kezelést ezzel a gyógyszerrel, el kell végezni Önnél és partnerénél a meddőség lehetséges okainak orvosi kivizsgálását.
Ne alkalmazza a REKOVELLE-t:
- ha allergiás a tüszőserkentő hormonra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére;
- ha méh-, petefészek- vagy emlődaganatban, illetve ha az agyalapi mirigyet vagy a hipotalamuszt érintő daganatban szenved;
- ha petefészkei megnagyobbodtak vagy petefészkein folyadéktartalmú tömlők (ciszták) találhatók (kivéve, ha policisztás ovárium szindróma okozta);
- ha ismeretlen eredetű hüvelyi vérzésben szenved;
- ha havivérzései korán abbamaradtak (korai menopauza);
- ha a nemi szervek olyan fejlődési rendellenességei állnak fenn Önnél, amelyek kizárják a normál terhesség lehetőségét.
- méhében miómák vannak, amelyek kizárják a normál terhesség lehetőségét.
Figyelmeztetések és óvintézkedések
A Rekovelle alkalmazása előtt beszéljen kezelőorvosával.
Petefészek-hiperstimulációs szindróma
A gonadotropinok - mint amilyen ez a gyógyszer is - petefészek-hiperstimulációs szindrómát idézhetnek elő. Ez az az állapot, amikor a tüszők túlfejlődnek, és nagy cisztákká alakulnak. Tájékoztassa kezelőorvosát:
- ha a hasában jelentkező fájdalmat, kellemetlen érzést vagy haspuffadást tapasztal;
- ha hányingere van;
- ha hány;
- ha hasmenése jelentkezik;
- ha testsúlya gyarapodik;
- ha nehézlégzése van.
Kezelőorvosa a gyógyszer alkalmazásának abbahagyására kérheti Önt (lásd 4. pont).
Ha betartja az ajánlott adagot és adagolási rendet, kevésbé valószínű a petefészek-hiperstimulációs szindróma jelentkezése.
Véralvadási zavarok (tromboembóliás események)
Terhes nőknél nagyobb a vérrögképződés valószínűsége a vérerek (vénák vagy verőerek) belsejében. A meddőségi kezelés fokozhatja ennek kockázatát, különösen, ha Ön túlsúlyos, illetve ha Önnél vagy egyik családtagjánál (vérrokonánál) ismert véralvadási zavar (trombofília) áll fenn. Tájékoztassa kezelőorvosát, ha úgy véli, hogy ez vonatkozik Önre.
Petefészek-kocsánycsavarodás
Asszisztált reprodukciós eljárásokkal végzett kezelést követően beszámoltak petefészek-kocsánycsavarodásról (ovárium torzió). A petefészek kocsánycsavarodása a petefészek vérellátásának megszűnését idézheti elő.
Többes terhesség és veleszületett rendellenességek
Az asszisztált reprodukciós eljárásokkal végzett kezelés során a többes terhesség (például ikerterhesség) valószínűsége főként a méhbe behelyezett embriók számával, az embriók minőségével, valamint az életkorral mutat összefüggést. A többes terhesség egészségügyi szövődményekkel járhat Önre és gyermekeire nézve. Ezenkívül, meddőségi kezelés után kis mértékben magasabb lehet a veleszületett rendellenességek kockázata, ami vélhetően a szülők jellemzőinek (például az Ön életkora, és partnere hímivarsejtjeinek jellemzői), valamint a többes terhességnek tudható be.
A terhesség elvesztése
Ha asszisztált reprodukciós eljárással végzett kezelésen esik át, nagyobb lehet a vetélés bekövetkezésének valószínűsége, mint természetes fogamzás esetén.
Méhen kívüli terhesség (ektópiás terhesség)
Ha asszisztált reprodukciós eljárással végzett kezelésen esik át, nagyobb lehet a méhen kívüli terhesség (ektópiás terhesség) bekövetkezésének valószínűsége, mint természetes fogamzás esetén. Ha kórelőzményében a petevezeték betegsége szerepel, fokozott a méhen kívüli terhesség kockázata.
A petefészek és egyéb nemi szervek daganatai
Meddőségi kezelésen átesett nőknél beszámoltak a petefészek és egyéb nemi szervek daganatairól. Nem ismert, hogy a meddőség elleni gyógyszerek fokozzák-e az említett daganatok kockázatát meddő nőknél.
Egyéb betegségek
A gyógyszerrel végzett kezelés megkezdése előtt azt is mondja el kezelőorvosának,
- ha korábban arról tájékoztatta Önt egy másik orvos, hogy a terhesség veszélyes lenne az Ön számára;
- ha vese- vagy májbetegsége van.
Gyermekek és serdülők (18 éves kor alatt)
Ez a gyógyszer gyermekek és serdülők számára nem javallott.
Egyéb gyógyszerek és a REKOVELLE
Feltétlenül tájékoztassa kezelőorvosát a jelenleg vagy nemrégiben alkalmazott, valamint alkalmazni tervezett egyéb gyógyszereiről.
Terhesség és szoptatás
Ha terhes vagy szoptat, ne alkalmazza ezt a gyógyszert.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
Ez a gyógyszer nem befolyásolja a gépjárművezetéshez és a gépek kezeléséhez szükséges képességeit.
A REKOVELLE nátriumot tartalmaz
A készítmény kevesebb mint 1 mmol (23 mg) nátriumot tartalmaz adagonként, azaz gyakorlatilag "nátriummentes".
3. Hogyan kell alkalmazni a REKOVELLE-t?
A gyógyszert mindig a kezelőorvosa által elmondottaknak megfelelően, és az előírt adagban alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát.
A REKOVELLE első ciklusban alkalmazandó adagját kezelőorvosa fogja kiszámítani az Ön vérében található anti-Müller-hormonszint (AMH, amely azt mutatja, hogy petefészkei hogyan fognak reagálni a gonadotropinokkal végzett stimulációra), valamint az Ön testtömege alapján. Ezért a kezelés megkezdése előtt rendelkezésre kell állnia egy (12 hónapon belül vett) vérmintából meghatározott AMH-eredménynek. Testtömegét a kezelés megkezdése előtt is meg fogják mérni. A REKOVELLE adagja mikrogrammban van kifejezve.
A REKOVELLE-ből állandó adagot kell alkalmazni a teljes kezelési időszakban, a napi adag emelése vagy csökkentése nélkül. Kezelőorvosa ellenőrizni fogja a REKOVELLE-kezelés hatását, és leállítja a kezelést, ha már megfelelő számú petezsák van jelen. A tüszőérés végső fázisának kiváltásához általában humán koriogonadotropin (hCG) nevű gyógyszert adnak egyetlen injekcióban, 250 mikrogrammos vagy 5000 nemzetközi egységet tartalmazó adagban.
Ha szervezete túl gyengén vagy túl erősen reagál a kezelésre, kezelőorvosa úgy dönthet, hogy leállítja a REKOVELLE-kezelést. Ebben az esetben kezelőorvosa a korábbinál magasabb, illetve alacsonyabb napi adagot adhat Önnek a következő kezelési ciklusban.
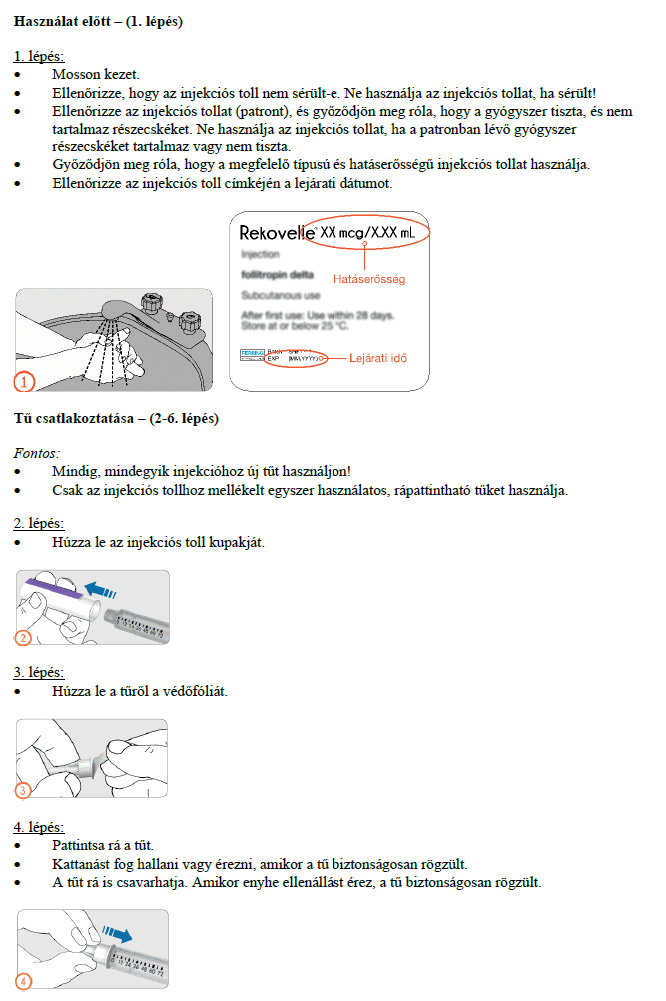
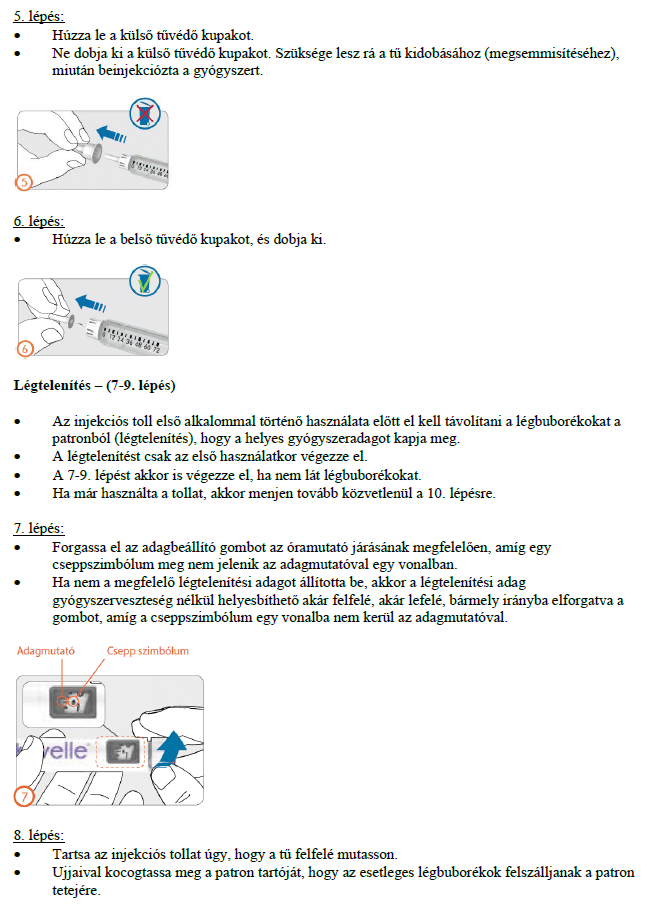
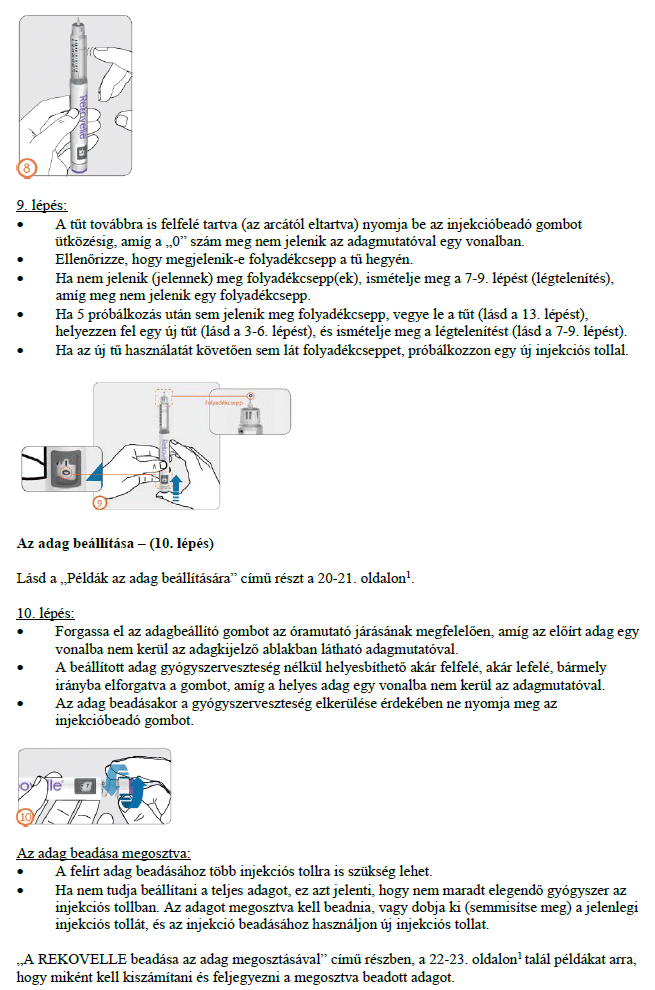
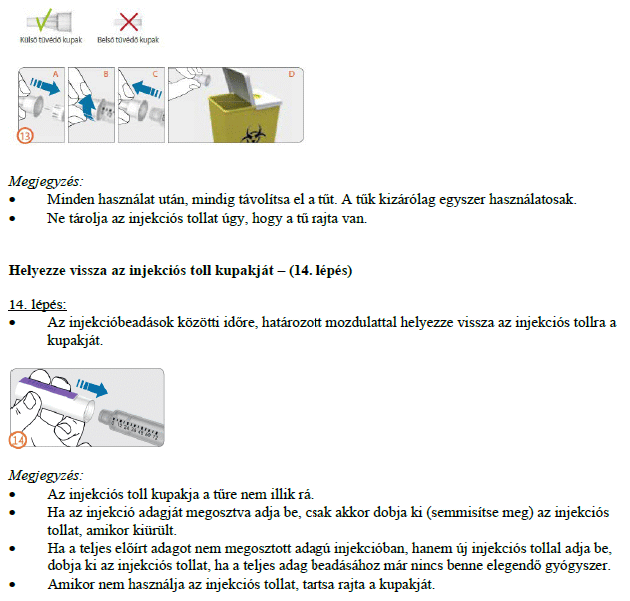
Hogyan kell beadni az injekciókat?
Az előretöltött injekciós toll használatára vonatkozó útmutatót gondosan be kell tartani. Ne használja az előretöltött injekciós tollat, ha az oldat nem tűnik tisztának.
A gyógyszerből az első injekciót egy orvos vagy a gondozását végző egészségügyi szakember felügyelete alatt kell beadni. Kezelőorvosa eldönti, hogy beadhatja-e Ön a gyógyszer további adagjait otthon magának, de erre csak azután kerülhet sor, hogy megfelelő oktatásban részesült.
Ez a gyógyszer kizárólag bőr alá adott (szubkután) injekció formájában alkalmazandó, és általában a hasba kell beadni. Az előretöltött injekciós toll több injekció beadásához alkalmazható.
Ha az előírtnál több REKOVELLE-t alkalmazott
A gyógyszerből túl nagy mennyiség beadásának hatásai nem ismertek. Esetlegesen jelentkezhet petefészek-hiperstimulációs szindróma, melynek ismertetése a 4. pontban található.
Ha elfelejtette alkalmazni a REKOVELLE-t
Ne alkalmazzon kétszeres adagot a kihagyott adag pótlására. Forduljon kezelőorvosához, amint észlelte, hogy elfelejtett beadni egy adagot.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Súlyos mellékhatások:
A meddőség kezelése során alkalmazott hormonok - mint amilyen ez a gyógyszer is - a petefészkek túlműködését idézhetik elő (petefészek-hiperstimulációs szindróma, OHSS). Ennek tünetei közé tartozhat a hasban jelentkező fájdalom, kellemetlen érzés vagy puffadás, hányinger, hányás, hasmenés, testsúlygyarapodás vagy nehézlégzés. Azonnal forduljon orvoshoz, ha ezen tünetek bármelyike fennáll Önnél.
Egy adott mellékhatás jelentkezésének kockázatát a következő gyakorisági osztályozással adják meg:
Gyakori (10 személy közül legfeljebb 1 személyt érinthet):
- fejfájás;
- hányinger;
- petefészek-hiperstimulációs szindróma (lásd fent);
- kismedencei fájdalom és kellemetlen érzés, a petefészek-eredetűt is beleértve,
- a petefészkekben vagy petevezetékekben jelentkező fájdalom;
- fáradékonyság (kimerültség).
Nem gyakori (100 személy közül legfeljebb 1 személyt érinthet):
- hangulatingadozások;
- aluszékonyság/álmosság;
- szédülés;
- hasmenés;
- hányás;
- székrekedés;
- a hasban jelentkező kellemetlen érzés;
- hüvelyi vérzés;
- az emlőt érintő kellemetlen érzés (köztük emlőfájdalom, emlőduzzanat, az emlő érzékenysége és/vagy mellbimbófájdalom).
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát vagy gyógyszerészét. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az alábbi elérhetőségek valamelyikén keresztül:
Nemzeti Népegészségügyi és Gyógyszerészeti Központ, Postafiók 450, H-1372 Budapest
honlap: www.ogyei.gov.hu
elektronikus bejelentő form: https://mellekhatas.ogyei.gov.hu/
e-mail: adr.box@ogyei.gov.hu
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a REKOVELLE-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
Az előretöltött injekciós toll címkéjén és a dobozon feltüntetett lejárati idő (Felhasználható/Felh.) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Hűtőszekrényben (2 °C - 8 °C) tárolandó. Nem fagyasztható!
A fénytől való védelem érdekében az eredeti csomagolásban tárolandó.
A REKOVELLE 25 °C-on vagy alacsonyabb hőmérsékleten tárolható legfeljebb 3 hónapon át, az első használat utáni időszakot is beleértve. Tilos újra hűtőszekrénybe tenni, és meg kell semmisíteni, amennyiben 3 hónap elteltével nem került felhasználásra.
Első használat után: legfeljebb 25 °C-os hőmérsékleten történő tárolás esetén 28 nap.
A fel nem használt oldatot a kezelés végén meg kell semmisíteni.
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a REKOVELLE?
- A készítmény hatóanyag a delta-follitropin.
Mindegyik többadagos patronú előretöltött injekciós toll 12 mikrogramm delta-follitropint tartalmaz az oldat 0,36 milliliterében. Az oldat 33,3 mikrogramm delta-follitropint tartalmaz milliliterenként.
- Egyéb összetevők a fenol, poliszorbát 20, L-metionin, nátrium-szulfát-dekahidrát, dinátrium-foszfát-dodekahidrát, tömény foszforsav, nátrium-hidroxid, injekcióhoz való víz.
Milyen a REKOVELLE külleme és mit tartalmaz a csomagolás?
A REKOVELLE tiszta és színtelen oldatos injekció előretöltött injekciós tollban (injekció). 1 db előretöltött injekciós tollat és 3 db, az injekciós tollhoz való injekciós tűt tartalmazó csomagokban kerül forgalomba.
Használati utasítás
REKOVELLE előretöltött injekciós toll
delta-follitropin



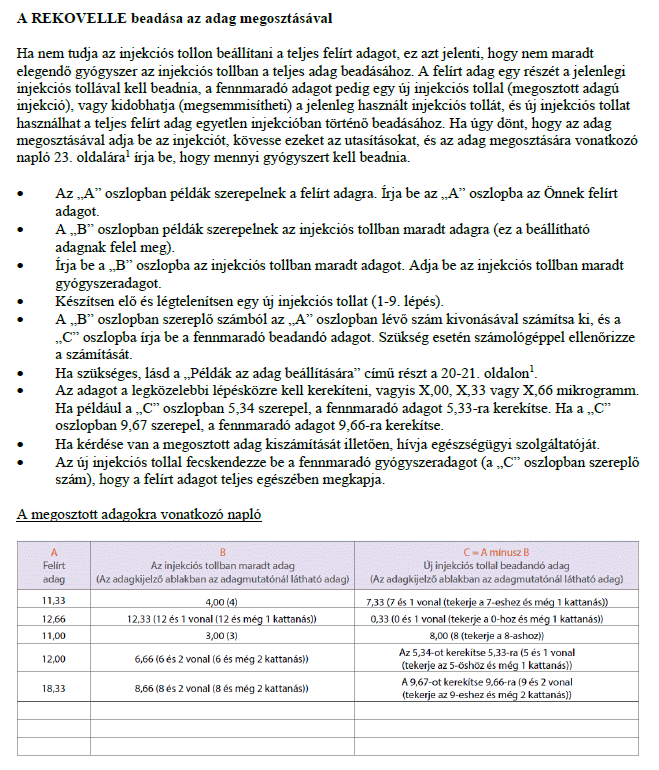

1 Az oldalszámok a Használati utasítás brosúrájának kinyomtatott változatára, és nem a jelen dokumentum tényleges oldalszámaira vonatkoznak
A szöveg publikálásának dátuma az ema.europa.eu weboldalon: 2023. 10. 04.
