UPTRAVI 1400 µg filmtabletta
Hatóanyag:
selexipag
Csak vényre kapható
Kiszerelés:
60x buborékcsomagolásban

Tájékoztató ár:
-
Normatív TB-támogatás:
Nem
Eü. emelt támogatás:
Nem
-
Gyógyszerfőkategória:
ANTITHROMBOTIKUS GYÓGYSZEREK
-
Törzskönyvi szám:
EU/1/15/1083/009
-
Gyógyszeralkategória:
Thrombocyta-aggregatio gátlók, kivéve heparin
-
Gyártó:
Janssen-Cilag International
Betegtájékoztató
1. Milyen típusú gyógyszer az Uptravi és milyen betegségek esetén alkalmazható?
Az Uptravi egy olyan gyógyszer, amelynek hatóanyaga a szelexipag. A prosztaciklinnek nevezett természetes anyaghoz hasonlóan az erekre fejti ki hatását, ellazítja és tágítja azokat.
Az Uptravi a tüdőartéria magas vérnyomásának (pulmonális artériás hipertónia, PAH) hosszú távú kezelésére szolgál olyan felnőtt betegeknél, akiknél az egyéb, endotelinreceptor-antagonistaként és 5. típusú foszfodiészteráz-gátlóként ismert, a PAH kezelésére szolgáló gyógyszerekkel történő kezelés nem elégséges. Az Uptravi önmagában, monoterápiában is alkalmazható a fenti terápiákra nem alkalmas betegek esetében.
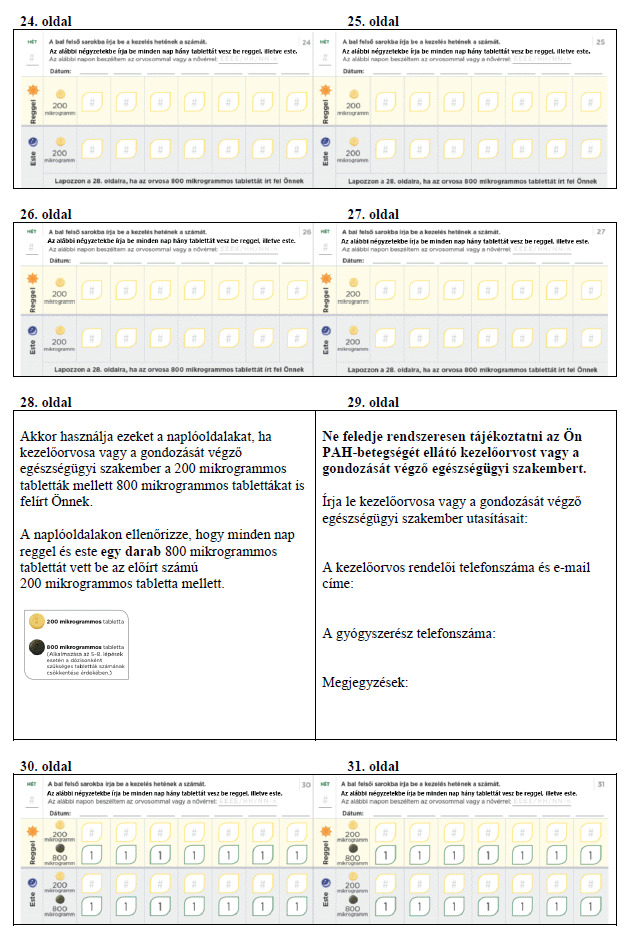
A PAH azt jelenti, hogy magas a vérnyomás azokban a vérerekben (a tüdőartériákban), amelyek a szívből a tüdő felé viszik a vért. A PAH-betegségben szenvedőknél ezek a verőerek beszűkülnek, ezért a szívnek fokozott munkát kell végeznie, hogy keresztül tudja pumpálni ezeken a vért. Emiatt a beteg fáradtnak érezheti magát, szédülhet, légszomja lehet vagy más tüneteket tapasztalhat.
A természetes prosztaciklinhez hasonló módon hatva, ez a gyógyszer kitágítja a tüdőartériákat, és csökkenti az érfalak merevségét. Ennek köszönhetően a szív könnyebben tudja keresztülpumpálni a vért a tüdőartériákon. Az Uptravi csökkenti a nyomást a tüdőartériákban, csökkenti a PAH tüneteit, és lassítja a PAH-betegség súlyosbodását.
2. Tudnivalók az Uptravi szedése előtt
Ne szedje az Uptravi-t
- ha allergiás a szelexipagra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
- ha szívpanasza van, például:
-- rossz a véráramlás a szívizmaiban (súlyos koszorúér-betegség vagy instabil angina), a tünetek között mellkasi fájdalom is szerepelhet;
-- szívroham az elmúlt 6 hónap során;
-- szívgyengeség (dekompenzált szívelégtelenség), amely nem áll szoros orvosi felügyelet alatt;
-- súlyos szívritmuszavar;
-- a szívbillentyűk (veleszületett vagy szerzett) zavara, ami miatt rosszul működik a szív (nem a tüdőartéria magas vérnyomása miatt).
- ha az elmúlt 3 hónapban szélütése volt, vagy ha bármilyen olyan esemény történt, ami csökkentette az agy vérellátását (pl. átmeneti keringészavar okozta agyi történés);
- ha gemfibrozilt szed (a vérben található zsírok (lipidek) szintjének csökkentésére használt gyógyszer).
Figyelmeztetések és óvintézkedések
Az Uptravi szedése előtt beszéljen az Ön PAH-betegségét ellátó kezelőorvosával vagy a gondozását végző egészségügyi szakemberrel, ha
- magas vérnyomás elleni gyógyszert szed;
- alacsony a vérnyomása, amelyet tünetek, például szédülés kísér;
- a közelmúltban jelentős mennyiségű vért vagy folyadékot veszített, például erős hasmenés vagy hányás miatt;
- pajzsmirigybetegségei vannak;
- súlyos vesepanaszai vannak, vagy ha művesekezelésben részesül;
- most vagy korábban súlyos problémái voltak rosszul működő májával.
Azonnal forduljon kezelőorvosához, ha a fenti tünetek bármelyikét észleli, vagy ha állapotában változás áll be.
Gyermekek és serdülők
18 évesnél fiatalabb gyermekek és serdülők esetén a gyógyszer alkalmazása tilos, mert az Uptravi-t még nem vizsgálták gyermekeknél.
Idős betegek
A 75 évesnél idősebb betegeknél a rendelkezésre álló tapasztalat korlátozott az Uptravi alkalmazását illetően. Ebben a korcsoportban óvatosan kell alkalmazni az Uptravi-t.
Egyéb gyógyszerek és az Uptravi
Tájékoztassa kezelőorvosát a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről.
Más gyógyszerek alkalmazása befolyásolhatja az Uptravi hatását.
Kérjük, tájékoztassa az Ön PAH-betegségét ellátó kezelőorvosát vagy a gondozását végző egészségügyi szakembert, ha a következő gyógyszerek valamelyikét szedi:
- gemfibrozil (a vérben található zsírok (lipidek) szintjének csökkentésére használt gyógyszer);
- klopidogrel (koszorúér-betegség esetén a vérrögök kialakulásának a megakadályozására használt gyógyszer);
- deferazirox (a vas véráramból való eltávolítására használt gyógyszer);
- teriflunomid (relapszáló-remittáló szklerózis multiplex kezelésére használt gyógyszer);
- karbamazepin (az epilepszia bizonyos formáinak, idegi eredetű fájdalomnak a kezelésére, vagy súlyos hangulatzavaroknak a kezelésére használt gyógyszer, amikor néhány más gyógyszer nem működik);
- fenitoin (az epilepszia kezelésére használt gyógyszer);
- valproinsav (az epilepszia kezelésére használt gyógyszer);
- probenecid (a köszvény kezelésére használt gyógyszer);
- flukonazol, rifampicin vagy rifapentin (fertőzések kezelésére használt antibiotikumok).
Terhesség és szoptatás
Az Uptravi alkalmazása nem javallt terhesség és szoptatás alatt. Ha Ön fogamzóképes korú nő, akkor hatékony fogamzásgátló módszert kell alkalmaznia az Uptravi szedése alatt. Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
Az Uptravi mellékhatásként fejfájást és alacsony vérnyomást okozhat (lásd 4. pont), amelyek befolyásolhatják az Ön gépjárművezetési képességét. Lehetséges, hogy a betegsége tünetei miatt is csökken a vezetésre való alkalmassága.
3. Hogyan kell szedni az Uptravi-t?
Uptravi-t kizárólag a PAH kezelésében jártas orvos írhat fel. Ezt a gyógyszert mindig a kezelőorvosa által elmondottaknak megfelelően szedje. Amennyiben kétségei vannak, vagy ha kérdése van, kérdezze meg kezelőorvosát.
Értesítse kezelőorvosát, ha mellékhatásokat tapasztal, ugyanis kezelőorvosa az Uptravi adagolás módosítását javasolhatja.
Értesítse kezelőorvosát, ha egyéb gyógyszereket is szed, ugyanis kezelőorvosa javasolhatja az Uptravi csak napi egyszeri szedését.
Ha rosszul lát vagy a vakság bármilyen formájában szenved, kérjen segítséget az Uptravi alkalmazásához az adagbeállítási (titrálási) időszakban (az adagja fokozatos emelésének folyamata).
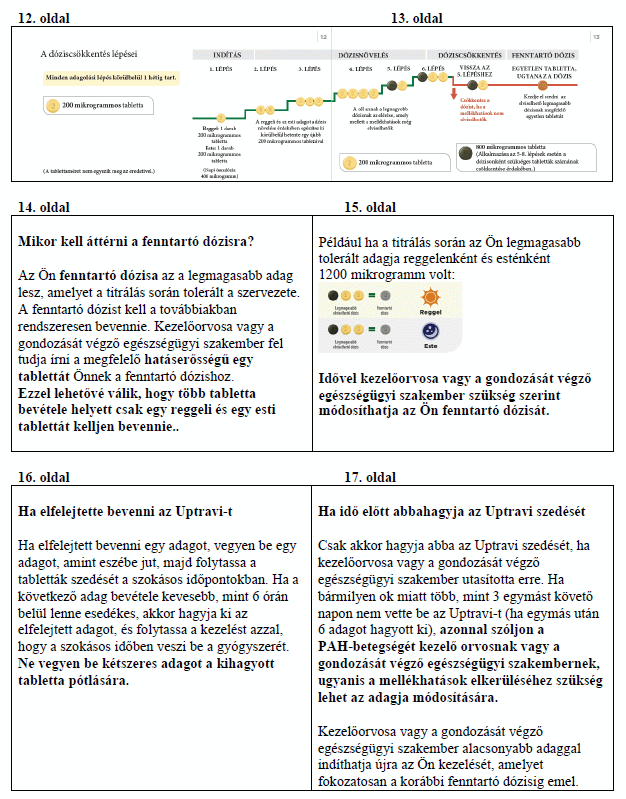
Az Önnek megfelelő adag megtalálása
A kezelés kezdetén a legkisebb adagot kapja. Ez egy darab 200 mikrogrammos tabletta reggel, majd egy újabb 200 mikrogrammos tabletta este, megközelítőleg 12 óránként. A kezelés elkezdése este javasolt. Kezelőorvosa elmondja, hogy fokozatosan emelnie kell majd az adagot. Ezt a folyamatot titrálásnak nevezzük. A titrálás lehetővé teszi, hogy szervezete alkalmazkodjon az új gyógyszerhez. A titrálás célja megtalálni az leginkább megfelelő adagot. Ez az Ön szervezete által elviselt legmagasabb adag lesz, ami elérheti az 1600 mikrogramm maximális adagot reggel és este.
Először azt a csomagot kapja meg, amely a világossárga színű 200 mikrogrammos tablettákat tartalmazza.
Kezelőorvosa elmagyarázza Önnek, hogyan emelje lépésenként az adagját. Erre rendszerint hetenként kerül sor, de két adagnövelés között akár hosszabb idő is eltelhet.
Minden lépésnél egy 200 mikrogrammos tablettát ad hozzá a reggeli adagjához és egy másik 200 mikrogrammos tablettát az esti adagjához. Az emelt adag első bevétele este javasolt. Az alábbi ábra bemutatja, hogy az első 4 lépés során hány tablettát kell bevennie reggelenként és esténként.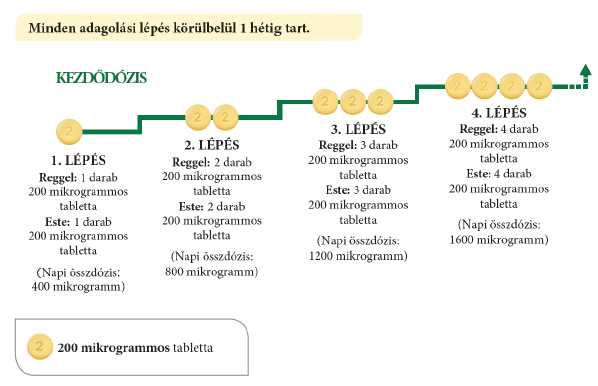
Ha kezelőorvosa az adag még további emelését kéri, akkor minden újabb lépésben egy 200 mikrogrammos tablettát kell hozzáadnia a reggeli és egy 200 mikrogrammos tablettát az esti adagjához. Az emelt adagot első alkalommal este javasolt bevenni.
Ha kezelőorvosa arra kéri Önt, hogy folytassa az adag növelését, és haladjon tovább az 5. lépéssel, akkor ezt a következőképpen teheti: vegyen be egy zöld színű 800 mikrogrammos tablettát és egy világossárga színű 200 mikrogrammos tablettát reggel, valamint egy 800 mikrogrammos tablettát és egy 200 mikrogrammos tablettát este.
Az Uptravi maximális adagja 1600 mikrogramm reggel és 1600 mikrogramm este. Azonban nem minden beteg éri el ezt az adagot, mert egyénileg változik, kinek mekkora adagra van szüksége.
Az alábbi ábrán látható a reggel és este bevett tabletták száma minden egyes lépésnél, kezdve az 5. lépéssel.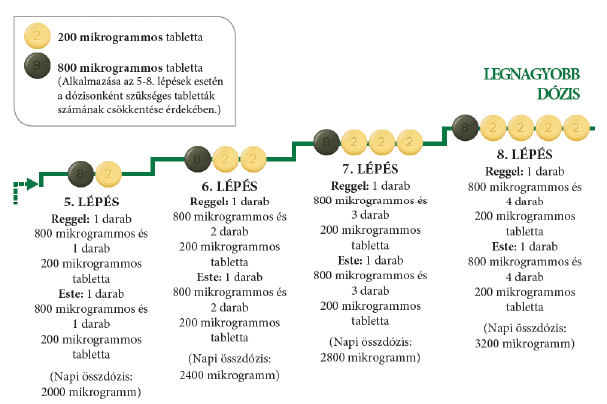
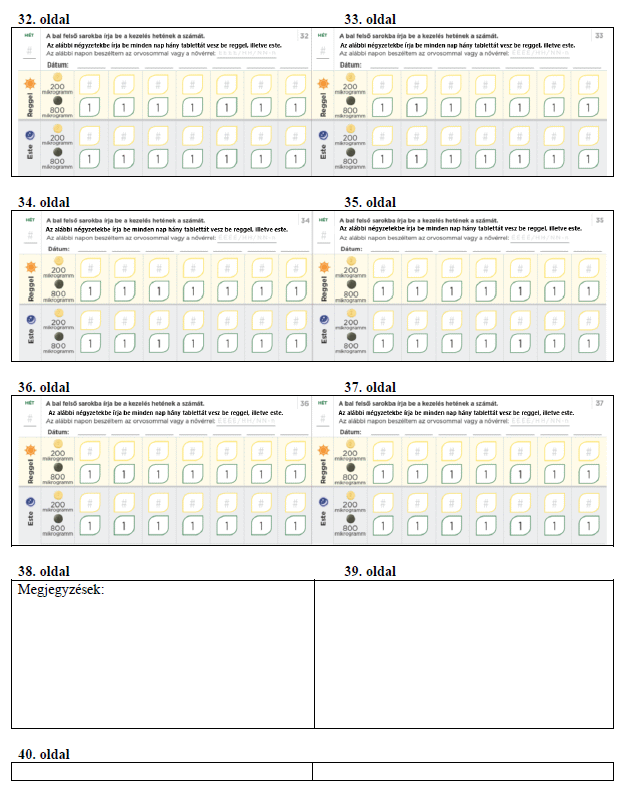
Meg fogja kapni a titrálócsomagot, ami tartalmaz egy titrálási útmutatót és egy Betegtájékoztatót. A titrálási útmutató információt ad a titrálás folyamatáról, és lehetővé teszi, hogy minden nap feljegyezze a bevett tabletták számát.
Ne feledje minden nap felírni a titrálási naplóba, hány tablettát vett be aznap. A titrálás egyes lépései rendszerint körülbelül 1 hétig tartanak. Ha kezelőorvosa arra kéri, hogy nyújtsa meg a titrálási lépéseket úgy, hogy azok hosszabbak legyenek 1 hétnél, akkor ezt a tartalék naplólapokon követheti a feljegyzéseivel. Ne feledje a titrálás során rendszeresen tájékoztatni az Ön PAH-betegségét ellátó kezelőorvost vagy a gondozását végző egészségügyi szakembert.
Az adag csökkentése mellékhatások miatt
A titrálás során mellékhatásokat tapasztalhat, például fejfájást, hasmenést, hányingert, hányást, állkapocsfájdalmat, izomfájdalmat, lábfájdalmat, ízületi fájdalmat vagy az arc kipirulását (lásd 4. pont). Ha nehezen tudja elviselni ezeket a mellékhatásokat, beszélje meg kezelőorvosával, hogyan csillapíthatja vagy kezelheti azokat. Bizonyos kezelések segíthetnek elmulasztani a mellékhatásokat. Fájdalomcsillapítókkal, például paracetamollal kezelhető a fájdalom és a fejfájás.
Ha a mellékhatásokat nem lehet kezelni vagy ha nem tűnnek el fokozatosan az éppen alkalmazott adag mellett, kezelőorvosa módosíthatja az adagját úgy, hogy eggyel kevesebb 200 mikrogrammos, világossárga színű tablettát kelljen bevennie reggel és este egyaránt. Az alábbi ábra mutatja az alacsonyabb adagra való visszalépés folyamatát. Ezt csak akkor végezze el, ha a kezelőorvosa utasította Önt erre.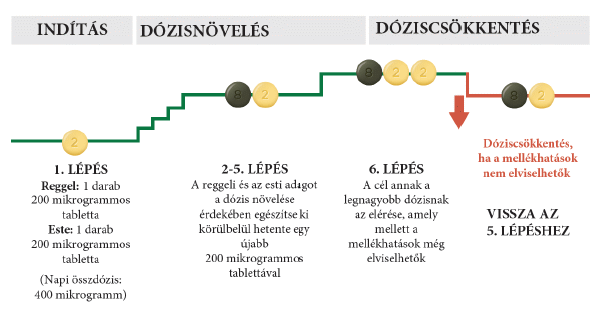
Ha az adag csökkentése után kontrollálhatóvá válnak az Önnél észlelt mellékhatások, kezelőorvosa dönthet úgy, hogy a továbbiakban is ezt az adagot alkalmazza. Kérjük, olvassa el az alábbi Fenntartó dózis című részt a további információkért.
Fenntartó dózis
Az Ön fenntartó dózisa az a legmagasabb adag lesz, amelyet a titrálás során tolerált a szervezete. A fenntartó dózist kell a továbbiakban rendszeresen bevennie.
Kezelőorvosa a megfelelő erősségű tablettát fogja felírni Önnek a fenntartó dózishoz. Így lehetősége nyílik arra, hogy reggel és este csak egy-egy tablettát vegyen be, ne pedig többet.
Az Uptravi tabletták teljes leírását, beleértve színüket és jelölésüket is a betegtájékoztató 6. pontjában találja.
Idővel kezelőorvosa szükség szerint módosíthatja a fenntartó dózisát.
Ha egy adagot régóta alkalmaz, és bármikor olyan mellékhatásokat tapasztal, amelyeket nem tud elviselni, vagy amelyek befolyásolják a mindennapos életvitelét, forduljon kezelőorvosához, mert lehetséges, hogy csökkenteni kell az adagját. Ekkor kezelőorvosa alacsonyabb hatáserősségű, egy tablettából álló kezelést írhat fel Önnek. Kérjük, ne feledje el ártalmatlanítani a fel nem használt tablettákat (lásd 5. pont).
Az Uptravi-t reggel és este egyszer-egyszer, körülbelül 12 órás időközzel vegye be.
Étkezés közben vegye be a tablettákat, mert így szervezete jobban tolerálhatja a gyógyszert. A tabletta bevonat védelmet biztosít. A tablettákat egészben, egy pohár vízzel nyelje le. A tablettákat ne törje össze, szétrágás nélkül kell bevenni.
Ha az előírtnál több Uptravi-t vett be
Ha az előírtnál több tablettát vett be, forduljon kezelőorvosához.
Ha elfelejtette bevenni az Uptravi-t
Ha elfelejtette bevenni az Uptravi-t, vegyen be egy adagot, amint eszébe jut, majd folytassa a tabletták szedését a szokásos időpontokban. Ha már közel van a következő adag bevételének időpontja (kevesebb, mint 6 óra múlva be kellene vennie), akkor hagyja ki az elfelejtett adagot, és folytassa a gyógyszer szedését a szokásos időpontban. Ne vegyen be kétszeres adagot a kihagyott tabletta pótlására.
Ha idő előtt abbahagyja az Uptravi szedését
Az Uptravi-kezelés hirtelen abbahagyásakor rosszabbodhatnak a tünetei. Csak akkor hagyja abba az Uptravi szedését, ha kezelőorvosa utasította erre. Kezelőorvosa arra kérheti, hogy a gyógyszer teljes megvonása előtt fokozatosan csökkentse az adagot.
Ha bármilyen ok miatt több mint 3 egymást követő napon nem vette be az Uptravi-t (tehát ha kihagyott 3 reggeli és 3 esti adagot, vagy egymás után legalább 6 adagot), azonnal forduljon kezelőorvosához, mert lehetséges, hogy a mellékhatások elkerüléséhez módosítani kell az adagját. Kezelőorvosa dönthet úgy, hogy egy alacsonyabb dózissal indítja újra a kezelését, majd fokozatosan a korábbi fenntartó dózisig emeli azt.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy a gondozását végző egészségügyi szakembert.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek. Lehetséges, hogy nemcsak a titrálási időszakban, a dózis növelése során tapasztal mellékhatásokat, hanem később is, amikor ugyanazt az adagot már régebb óta szedi.
Ha a következő mellékhatások bármelyikét tapasztalja: fejfájás, hasmenés, hányinger, hányás, állkapocsfájdalom, izomfájdalom, lábfájdalom, ízületi fájdalom vagy az arc kipirulása, és nem tudja elviselni vagy nem lehet kezelni a mellékhatást, akkor forduljon kezelőorvosához, mert lehetséges, hogy túl magas adagot szed, és szükség lehet az adag csökkentésére.
Nagyon gyakori mellékhatások (10-ből több mint 1 beteget érinthet)
- Fejfájás
- Kipirulás (az arc kipirulása)
- Hányinger és hányás
- Hasmenés
- Állkapocsfájdalom, izomfájdalom, ízületi fájdalom, lábfájdalom
- Orr-garat gyulladás (orrdugulás)
Gyakori mellékhatások (10-ből legfeljebb 1 beteget érinthet)
- Vérszegénység (alacsony vörösvértestszám)
- Pajzsmirigy-túlműködés (hipertireózis)
- Étvágycsökkenés
- Testtömegcsökkenés
- Alacsony vérnyomás (hipotónia)
- Hasfájás, beleértve az emésztési zavarokat is
- Fájdalom
- Egyes vérvizsgálatok, például a vérsejtek számát vagy a pajzsmirigy működését mérő eljárások eredményeinek megváltozása
- Kiütések, beleértve a csalánkiütést, amelyek égő vagy szúró érzést és bőrpírt okozhatnak
Nem gyakori mellékhatások (100-ból legfeljebb 1 beteget érinthetnek)
- Gyorsult szívverés
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti a https://mellekhatas.ogyei.gov.hu/ weboldalon. A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell az Uptravi-t tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A dobozon és a buborékcsomagoláson feltüntetett lejárati idő ("EXP") után ne alkalmazza az Uptravi-t. A lejárati idő az adott hónap utolsó napjára vonatkozik.
Ez a gyógyszer nem igényel különleges tárolást.
A megsemmisítésre vonatkozóan nincsenek különleges előírások.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz az Uptravi?
A készítmény hatóanyaga a szelexipag.
Az Uptravi 200 mikrogramm filmtabletta 200 mikrogramm szelexipagot tartalmaz
Az Uptravi 400 mikrogramm filmtabletta 400 mikrogramm szelexipagot tartalmaz
Az Uptravi 600 mikrogramm filmtabletta 600 mikrogramm szelexipagot tartalmaz
Az Uptravi 800 mikrogramm filmtabletta 800 mikrogramm szelexipagot tartalmaz
Az Uptravi 1000 mikrogramm filmtabletta 1000 mikrogramm szelexipagot tartalmaz
Az Uptravi 1200 mikrogramm filmtabletta 1200 mikrogramm szelexipagot tartalmaz
Az Uptravi 1400 mikrogramm filmtabletta 1400 mikrogramm szelexipagot tartalmaz
Az Uptravi 1600 mikrogramm filmtabletta 1600 mikrogramm szelexipagot tartalmaz
Egyéb összetevők:
Tabletta mag
Mannit (E421)
Kukoricakeményítő
Alacsony szubsztitúciós fokú hidroxipropilcellulóz
Hidroxipropilcellulóz
Magnézium-sztearát
Filmbevonat
Hipromellóz
Propilénglikol
Titán-dioxid (E171)
Vas-oxidok (E172)
Karnaubaviasz
Az Uptravi 200 mikrogramm filmtabletta sárga vas-oxidot (E172) tartalmaz.
Az Uptravi 400 mikrogramm filmtabletta vörös vas-oxidot (E172) tartalmaz.
Az Uptravi 600 mikrogramm filmtabletta vörös és fekete vas-oxidot (E172) tartalmaz.
Az Uptravi 800 mikrogramm filmtabletta sárga és fekete vas-oxidot (E172) tartalmaz.
Az Uptravi 1000 mikrogramm filmtabletta vörös és sárga vas-oxidot (E172) tartalmaz.
Az Uptravi 1200 mikrogramm filmtabletta fekete és vörös vas-oxidot (E172) tartalmaz.
Az Uptravi 1400 mikrogramm filmtabletta sárga vas-oxidot (E172) tartalmaz.
Az Uptravi 1600 mikrogramm filmtabletta fekete, vörös és sárga vas-oxidot (E172) tartalmaz.
Milyen az Uptravi külleme és mit tartalmaz a csomagolás?
Uptravi 200 mikrogramm filmtabletta: Kerek, világossárga filmtabletta, egyik oldalán mélynyomásos "2" felirattal jelölve.
Uptravi 400 mikrogramm filmtabletta: Kerek, vörös filmtabletta, egyik oldalán mélynyomásos "4" felirattal jelölve.
Uptravi 600 mikrogramm filmtabletta: Kerek, világoslila filmtabletta, egyik oldalán mélynyomásos "6" felirattal jelölve.
Uptravi 800 mikrogramm filmtabletta: Kerek, zöld filmtabletta, egyik oldalán mélynyomásos "8" felirattal jelölve.
Uptravi 1000 mikrogramm filmtabletta: Kerek, narancssárga filmtabletta, egyik oldalán mélynyomásos "10" felirattal jelölve.
Uptravi 1200 mikrogramm filmtabletta: Kerek, sötétlila filmtabletta, egyik oldalán mélynyomásos "12" felirattal jelölve.
Uptravi 1400 mikrogramm filmtabletta: Kerek, sötétsárga filmtabletta, egyik oldalán mélynyomásos "14" felirattal jelölve.
Uptravi 1600 mikrogramm filmtabletta: Kerek, barna filmtabletta, egyik oldalán mélynyomásos "16" felirattal jelölve.
Az Uptravi 200 mikrogramm filmtabletta 10 db vagy 60 db tablettát, illetve 60 db vagy 140 db tablettát (titrálási csomagok) tartalmazó buborékcsomagolásban kerül forgalomba.
Az Uptravi 400 mikrogramm, 600 mikrogramm, 800 mikrogramm, 1000 mikrogramm, 1200 mikrogramm, 1400 mikrogramm és 1600 mikrogramm filmtabletta 60 db tablettát tartalmazó buborékcsomagolásban kerül forgalomba.
Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
TITRÁLÁSI ÚTMUTATÓ - TITRÁLÓCSOMAG

A szöveg publikálásának dátuma az ema.europa.eu weboldalon: 2022. 06. 28.
