VENOMENHAL Méh por és oldószer oldatos injekcióhoz
 Nem áll rendelkezésre kép
Nem áll rendelkezésre kép Hatóanyag:
méhméreg
Normatív TB-támogatás:
Eü. emelt támogatás:
Gyártó:
HAL Allergy B.V.
Ár:
42853 Ft A feltüntetett ár tájékoztató jellegű
Betegtájékoztató
1. Milyen típusú gyógyszer a Venomenhal Méh injekció és milyen betegségek esetén alkalmazható?
A Venomenhal Méh injekció diagnosztikus célra (ún. prick teszteléshez és intrakután bőrpróbához), valamint olyan Ig-E mediált rovarméreg-allergiás betegek oki terápiájára használható, akiknél méhcsípés után szisztémás allergiás reakció lép fel.
A diagnózis felállításához pontos esetfelvétel és allergiapróba szükséges.
2. Tudnivalók a Venomenhal Méh injekció alkalmazása előtt
Az immunterápia megkezdése előtt a beteg a következőkre legyen figyelemmel:
Az injekció beadása előtt az alábbi óvintézkedések betartása javasolt:
- A kezelőorvos kikérdezésének megfelelően a beteg számoljon be a legutóbbi injekció beadásakor, vagy a beadást követően fellépett esetleges tünetekről és panaszokról; és bármilyen heveny (akut) betegségéről.
- A kezelőorvos kikérdezésének megfelelően a beteg számoljon be az esetlegesen szedett egyéb gyógyszereiről, illetve a gyógyszerelésében történt változásokról.
A kezelőorvos a következőkre legyen figyelemmel:
- az immunterápiás oldat aktuálisan beadandó mennyiségét ellenőrizni, illetve szükség esetén a dózist módosítani kell;
- félős, vagy instabil vegetatív idegrendszerű betegeket célszerű lefektetni az injekció beadásához;
- az érbe történő beadást feltétlenül ki kell zárni visszaszíváspróba elvégzésével.
Az injekció beadása után a következőkre legyen figyelemmel:
- Az esetlegesen később fellépő mellékhatások esetén a beteg azonnal lépjen kapcsolatba a kezelőorvosával vagy az orvosi ügyelettel.
- Az injekció beadását követően legalább 30 (harminc) percig orvosi felügyelet alatt kell maradnia!
Nem alkalmazható a Venomenhal Méh injekció diagnosztikus bőrpróba céljára:
- Másodlagos bőrfertőzések (bakteriális fertőzések) esetén.
- A készítmény segédanyagaival szembeni túlérzékenység esetén.
Nem alkalmazható a Venomenhal Méh injekció immunterápia céljára az alábbi esetekben:
A gyógyszer egyes (a 6. pontban felsorolt) összetevőivel szembeni túlérzékenység;
Az allergiás megbetegedés célszervének gyulladásos-fertőző megbetegedése;
Az allergiás megbetegedés célszervének másodlagos megbetegedése (pl. kóros levegőgyülem {emfizéma}, hörgőtágulat {bronchiektázia});
Autoimmun betegségek (pl.: a vese, a pajzsmirigy, a központi idegrendszer autoimmun megbetegedései, reumatikus megbetegedések);
Immunhiányos állapotok (beleértve az immunszupresszív kezelést is);
Súlyos, nehezen kezelhető tüdőasztma {asztma bronchiale}, különösen tartósan fennálló 70% alatti FEV1 érték vagy tartós asztmás roham {status asthmaticus} esetén;
Epinefrin alkalmazását kizáró szív- és érrendszeri betegségek;
Béta-blokkoló gyógyszerrel vagy ACE-gátló gyógyszerrel folytatott kezelés;
Rosszindulatú daganatos megbetegedések meglévő tünetekkel.
A Venomenhal Méh injekció fokozott elővigyázatossággal alkalmazható (relatívan ellenjavallt) az alábbiak fennállása esetén:
- Akut súlyos allergiás reakció
- Úgynevezett béta-blokkolóval folytatott kezelés
- Terhesség
- Szív- és érrendszeri betegségek, melyekben az epinefrin alkalmazása ellenjavallt
Figyelmeztetések és óvintézkedések
A rovarméreg-immunterápia - amennyiben lehetséges - nem végezhető azoknál a betegeknél, akik a fent említett betegségek valamelyikében szenvednek. A kezelőorvosnak egyedi előny/kockázat elemzést kell végeznie. Ismételten előforduló rovarcsípés által kiváltott életet veszélyeztető reakció indokolhatja az immunterápia megkezdését, függetlenül a meglévő társbetegségektől, vagy a társbetegségek továbbfejlődésének kockázata mellett is.
A diagnosztikus és immunterápiás tevékenységét az orvos a saját maga által feloldott Venomenhal Méh injekció hígításaival végzi. Ezért a kezelőorvos számára elengedhetetlen a hígítás fokának gondos és részletes írásbeli dokumentálása és megjelölése az üvegcsén. Minden egyes beadás előtt ismételten ellenőrizni kell, hogy a megfelelő koncentrációt fogják-e alkalmazni, hogy a hígításnak megfelelő eltarthatósági időn belül van-e a készítmény, és hogy mekkora térfogatot (dózist) kell beadni.
Az injekció beadását megelőzően és a beadást követően a beteg tartózkodjon az erős fizikai megterheléssel járó tevékenységektől (sport, nehéz fizikai munka).
A tesztelésre használt bőrfelületen bizonyos bőrelváltozások (gyulladás, kiütés) megváltoztathatják a bőr reakciókészségét vagy súlyosan eltorzíthatják a bőrteszt eredményét.
Gyermekek és serdülők
5 éves kor alatti gyermekek kezelése minden gyermek esetén egyéni, alapos előny/kockázat elemzés elvégzését követően különös óvintézkedések betartása mellett lehetséges.
5 éves, vagy 5 éves kor feletti gyermekeknél végzett kezelések hatékonyságával kapcsolatban kevés klinikai adat áll rendelkezésre, azonban a kezelés biztonságosságára vonatkozó adatok nem mutatnak nagyobb kockázatot, mint felnőttek esetében.
Egyéb gyógyszerek és a Venomenhal Méh injekció:
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről, beleértve a vény nélkül kapható készítményeket is.
Immunterápia folytatása nem javallt párhuzamosan folytatott immunszuppresszív kezelés, béta-blokkoló gyógyszerrel vagy ACE-gátló gyógyszerrel folytatott kezelés esetén. Szisztémás allergiás reakció esetén a beteg béta-blokkoló gyógyszerrel vagy ACE-gátló gyógyszerrel folytatott kezelése az esetek többségében nem javallt. Amennyiben a kezelőorvos megállapítja, hogy a magas vérnyomás kezelése nem függeszthető fel hosszabb időre, az immunterápia kezdő periódusa alatt át kell térni más gyógyszerekre a magas vérnyomás kezeléséhez. A jól tolerált fenntartó adag elérésekor újrakezdhető a béta-blokkoló gyógyszerrel vagy ACE-gátló gyógyszerrel végzett kezelés.
A párhuzamosan végzett immunterápia módosíthatja a toleranciaküszöböt.
Az immunterápia alatt szedett allergiaellenes tüneti szerek (pl.: antihisztaminok, hízósejtdegranuláció-gátlók, vagy kortikoszteroidok) befolyásolhatják a betegek toleranciáját a korábban jól tolerált dózisokkal szemben, ezen kívül csökkenthetik a bőr reakciókészségét, ami hamis bőrteszt eredményhez vezethet.
Tájékoztassa kezelőorvosát, amennyiben védőoltást kell kapnia, mivel az immunterápia dózisának módosítására lehet szükség.
A megelőző célú immunizálást (védőoltás) a beteg legkorábban az utolsó Venomenhal Méh injekció beadását követő 7. nap elteltével kaphatja meg (kivéve az életmentő beavatkozást). A következő injekció beadásával várni kell az immunizációra adott reakciók teljes lecsengéséig és a beadás időpontja általában nem lehet korábban, mint a védőoltástól számított 7. nap.
Terhesség és szoptatás
Terhesség vagy szoptatás alatt a Venomenhal Méh injekcióval végzendő immunterápia megkezdésétől el kell tekinteni. A már megkezdett és jól tolerált immunterápia a kezelőorvossal való konzultációt követően a terhesség ideje alatt folytatható.
Az anya rovarcsípés által kiváltott súlyos, egész szervezetet érintő reakciója terhesség alatt súlyos kockázatot jelent a magzat számára is. Ezért a fogamzóképes korú nőbetegeknek javasolt az immunterápia elvégzése még teherbeesés előtt.
Szoptatás alatt lehet terápiát folytatni Venomenhal Méh injekcióval. Előzetesen a kezelőorvosnak minden esetben el kell végeznie az előny/kockázat arány elemzését!
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A Venomenhal Méh injekció kismértékben, vagy mérsékelten befolyásolja a gépjárművezetéshez és gépek kezeléséhez szükséges képességeket.
Az injekció beadását követően néha fáradtságérzet léphet fel. Ezt különösen gépjárművezetők, munkakörük szerint gépeket kezelők vegyék figyelembe.
3. Hogyan kell alkalmazni a Venomenhal Méh injekciót?
A gyógyszer kizárólag az orvos által előírt adagban és ideig alkalmazható.
Az allergén immunterápiát kizárólag allergológus vagy allergológiában jártas szakorvosok rendelhetik és végezhetik.
Ha az előírtnál több Venomenhal Méh injekciót alkalmaztak Önnél
Az előírtnál több Venomenhal Méh injekció alkalmazása esetén mellékhatások fordulhatnak elő (lásd 4. pont, Lehetséges mellékhatások).
Ha elfelejtette alkalmazni Venomenhal Méh injekciót
A Venomenhal Méh injekcióval végzett immunterápia előírt kezelési sémáját követni kell. Tájékoztassa orvosát, amennyiben ez valamilyen ok miatt nem lehetséges.
Ha idő előtt abbahagyja aVenomenhal Méh injekció alkalmazását
A Venomenhal Méh injekcióval végzett immunterápiát egymást követő 3-5 éven keresztül kell folytatni a megfelelő panaszmentes állapot kialakulása érdekében.
Ha bármilyen további kérdése van a készítmény alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát, gyógyszerészét, vagy a gondozását végző egészségügyi szakembert.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így a Venomenhal Méh injekció is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
A gyógyszer megfelelő alkalmazása esetén sem zárható ki teljes mértékben egyes nemkívánatos mellékhatások fellépése. Helyi reakciók mellett akár a bőrpróbák végzése során, akár az immunter��pia alatt eltérő súlyosságú, az egész szervezetre kiterjedő (szisztémás) reakciók léphetnek fel.
Különösen erősen szenzibilizált betegeknél az allergiás reakciók felerősödése fordulhat elő. Ezek általában az injekció beadását követő 30 percen belül lépnek fel:
- Fokozott helyi reakció a beadás helyén.
- A beteg jellemző allergiás tüneteinek együttes visszatérése enyhe szisztémás formában (csalánkiütés, viszketés, bőrvörösség, hányinger).
- Súlyosabb szisztémás reakciók (légzési nehézség, csalánkiütés, arcduzzadás {Quincke-ödéma}, szív- és érrendszeri zavarok (vérnyomás- és pulzusszám-változás).
- Rendkívül ritkán súlyos túlérzékenységi reakció (anafilaxiás sokk) is előfordulhat. A jellegzetes figyelmezető tünetek a nyelven és a nyelv alatt, a mellkasban, a tenyereken és talpakon jelentkező égő érzésből, testszerte viszketésből, forróságérzetből állnak (lásd: Mellékhatások kezelése).
Ritkán jelentkezhetnek az injekció beadása után nemkívánatos késői (Coombs és Gell szerint III. típusú) mellékhatások. Ezen szérumbetegség jellemző tünetei: láz, fájdalom, idegbántalom (ritkán), betegségérzet, duzzadt izületek, csalánkiütés és más érkárosodásra utaló tünetek. Ezek a tünetek az injekció beadását követően órákkal is felléphetnek. Ebben az esetben az immunterápiát meg kell szakítani.
Dózismódosítás felerősödött reakciók esetén
A túladagolásnak fokozott reakció lehet a következménye. A Venomenhal készítmények beadásával összefüggő helyi és/vagy szisztémás reakciók haladéktalan kezelést igényelnek és ezen felül a további injekciók dózisának megfelelő módosítását is.
Súlyos, az egész szervezetet érintő túlérzékenységi reakció esetén az orvosnak felül kell vizsgálni a terápia indokoltságát.
Súlyos szisztémás reakciót követően biztonsági okokból a terápia folytatása esetén a kezelést elölről kell kezdeni.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül.
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a Venomenhal Méh injekciót tárolni?
A gyógyszer gyermekektől elzárva tartandó!
Nem fagyasztható!
Azok az oldatok, amelyek akár csak egyetlen alkalommal is megfagytak, nem használhatók a továbbiakban!
Felhasználhatósági időtartam
Rovarméreg és oldószer bontatlan injekciós üvegben: 3 év
Az elkészített oldatok lejárati ideje 2 °C-8 °C között tárolva: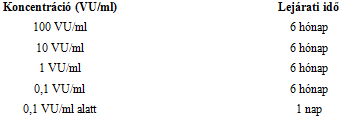
Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a Venomenhal Méh injekció?
A Venomenhal Méh por hatáserőssége biológiai aktivitási egységben (VU - venom unit) kerül megadásra.
Összetétel port tartalmazó injekciós üvegenként:
Méhméreg (Apis mellifera) 120 VU
Egyéb összetevők: humán albumin, mannit
Összetétel oldószert tartalmazó injekciós üvegenként:
humán albumin, nátrium-klorid, fenol, injekcióhoz való víz
Milyen aVenomenhal Méh injekció külleme és mit tartalmaz a csomagolás?
Por: fehér, liofilizált por
Oldószer: tiszta, színtelen oldat
Port tartalmazó injekciós üveg: kb. 24,5 mg liofilizált por, szilikonozott gumidugóval és lepattintható fedéllel lezárt injekciós üvegben (I-es típus).
Oldószert tartalmazó injekciós üveg: 1,2 ml oldószer, szilikonozott gumidugóval és lepattintható fedéllel lezárt injekciós üvegben (I-es típus).
Hat db port tartalmazó injekciós üveg és hat db oldószert tartalmazó injekciós üveg dobozban.
A betegtájékoztató engedélyezésének dátuma: 2018.04.01.
Kategóriák
ACNE-ELLENES KÉSZÍTMÉNYEK
ANTIBIOTICUMOK ÉS CHEMOTHERAPEUTICUMOK BŐRGYÓGYÁSZATI HASZNÁLATRA
ANTISEPTICUMOK ÉS FERTŐTLENÍTŐK
BŐRLÁGYÍTÓ- ÉS VÉDŐANYAGOK
CORTICOSTEROIDOK, BŐRGYÓGYÁSZATI KÉSZÍTMÉNYEK
EGYÉB BŐRGYÓGYÁSZATI KÉSZÍTMÉNYEK
GOMBÁSODÁS ELLENI BŐRGYÓGYÁSZATI SZEREK
GYÓGYSZERTARTALMÚ KÖTSZEREK
PSORIASIS ELLENI SZEREK
SEBEK ÉS FEKÉLYEK KEZELÉSÉRE SZOLGÁLÓ KÉSZÍTMÉNYEK
VISZKETÉS ELLENI SZEREK, BELEÉRTVE ANTIHISTAMINOK, ÉRZÉSTELENÍTŐK, STB.
ANTIDIABETIKUS TERÁPIA
ÁSVÁNYI ANYAGOK
DIGESTIVUMOK, BELEÉRTVE AZ ENZIMKÉSZÍTMÉNYEKET
ELHÍZÁS ELLENI SZEREK A DIÉTÁS KÉSZÍTMÉNYEK KIVÉTELÉVEL
EPE- ÉS MÁJBETEGSÉGEK GYÓGYSZEREI
ÉTVÁGYGERJESZTŐK
FOGÁSZATI KÉSZÍTMÉNYEK
FUNKCIONÁLIS GASTROINTESTINALIS BETEGSÉGEK ELLENI SZEREK
HÁNYÁSCSILLAPÍTÓK ÉS ÉMELYGÉS ELLENI SZEREK
HASMENÉSGÁTLÓK, VALAMINT A BÉL GYULLADÁSOS ÉS FERTŐZÉSES MEGBETEGEDÉSEINEK SZEREI
ROBORÁLÓ SZEREK
SAVTERMELÉS ZAVARÁVAL JÁRÓ BETEGSÉGEK GYÓGYSZEREI
SYSTEMÁS ANABOLICUMOK
SZÉKREKEDÉS ELLENI SZEREK
TÁPCSATORNA ÉS ANYAGCSERE EGYÉB GYÓGYSZEREI
VITAMINOK

Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja
Ⓒ Vidal Next kft. 2026.