BENEFIX 3000 NE por és oldószer oldatos injekcióhoz
Betegtájékoztató
1. Milyen típusú gyógyszer a BeneFIX és milyen betegségek esetén alkalmazható?
A BeneFIX egy injekcióban adható IX-es véralvadási (koagulációs) faktor-készítmény, melyet rekombináns DNS technológiával állítottak elő. A BeneFIX hatóanyaga az alfa-nonakog. Azoknak, akik hemofília B betegséggel (Christmas betegség) születtek, nincsen elegendő IX-es alvadási faktoruk a vérzés megfékezéséhez. A BeneFIX úgy hat, hogy pótolja a hemofília B-ben szenvedő betegek IX-es alvadási faktorát, és így lehetővé teszi náluk a véralvadást.
A BeneFIX-et a hemofília B-ben (veleszületett IX-es faktor hiány) szenvedő betegeknél vérzés kezelésére és megelőzésére alkalmazzák minden korcsoportban.
2. Tudnivalók a BeneFIX alkalmzazása előtt
Ne alkalmazza a BeneFIX-et
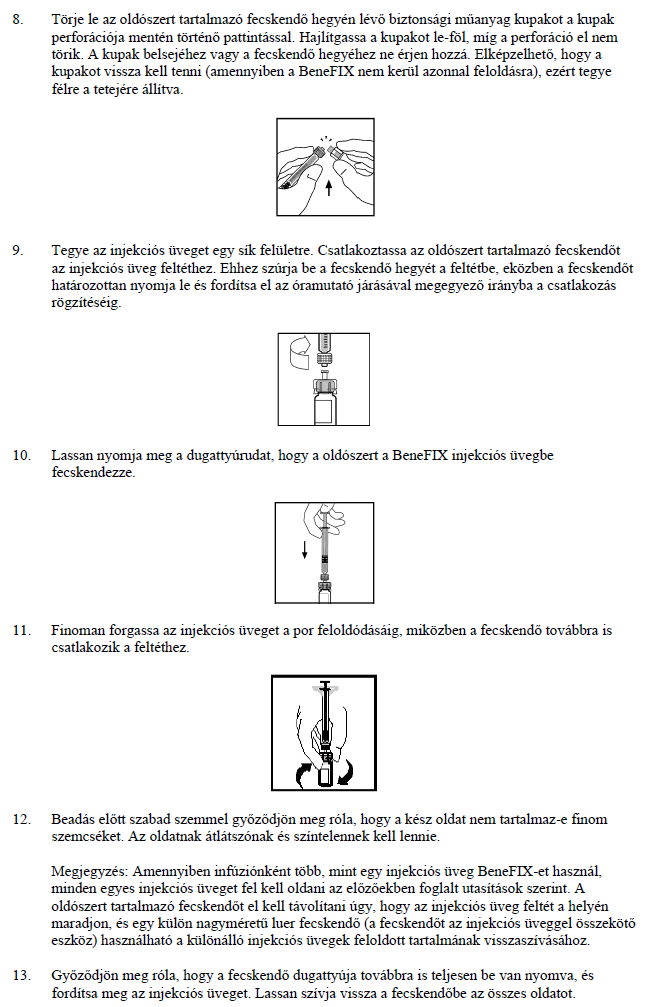
- Ha allergiás az alfa-nonakogra vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
- Ha allergiás a hörcsögfehérjékre.
Figyelmeztetések és óvintézkedések
- A BeneFIX alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
- Azonnal forduljon orvoshoz, ha a vérzés nem áll el úgy, ahogyan az várható lenne.
- Allergiás reakció előfordulhat. A készítmény nyomokban tartalmazhat hörcsögből származó fehérjéket (lásd Ne alkalmazza a BeneFIX-et). IX-es faktor készítmények esetén, ideértve a BeneFIX-et is, előfordultak lehetségesen életveszélyes anafilaktikus reakciók (súlyos allergiás reakciók). Az allergiás reakció korai jelei közé a nehézlégzés, légszomj, ödéma kialakulása, csalánkiütés, viszketés, testszerte jelentkező csalánkiütés (urtikária), mellkasi szorító érzés, ziháló (asztmás) légzés, alacsony vérnyomás, homályos látás és anafilaxia (súlyos allergiás reakció, mely nyelési és/vagy légzési nehézséget, az arc és/vagy a kéz pírját vagy duzzanatát okozhatja) tartozik.
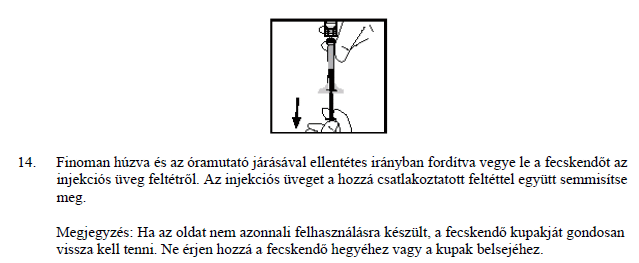
- Ha allergiás vagy anafilaktikus típusú reakció lép fel, azonnal függessze fel a készítmény adását, és haladéktalanul forduljon orvoshoz, vagy vegye igénybe a sürgősségi betegellátást. Súlyos allergiás reakció esetén más terápiás eljárás alkalmazását kell mérlegelni.
- Az aktivitást semlegesítő ellenanyagok (inhibitorok) előfordulása nem gyakori korábban már IX-es faktort tartalmazó készítménnyel kezelt betegeknél. Azonban, ahogyan minden IX-es faktor készítménynél, a BeneFIX-szel való kezelése során gondosan ellenőrizni kell Önnél a IX-es faktor inhibitorok kialakulását.
- Kutatások összefüggést mutattak a IX-es faktor inhibitor előfordulása és az allergiás reakciók között. Ezért, ha Önnél olyan allergiás reakció lép fel, mint amilyenek fent leírásra kerültek, akkor Önnél vizsgálni kell az inhibitor jelenlétét. Figyelembe kell venni, hogy a IX-es faktor inhibitorral rendelkező betegeknél a jövőben előforduló BeneFIX-szel történő kezeléskor fokozottabb lehet az anafilaxia kialakulásának veszélye.
- A szervezetben a IX-es faktor termelését a IX-es faktor gén irányítja. Azoknál a betegeknél, akikről ismeretes, hogy IX-es faktor génjükben specifikus mutációk vannak - mint amilyenek a jelentős törések -, nagyobb a valószínűsége annak, hogy IX-es faktor inhibitor alakul ki vagy allergiás reakciót tapasztalnak. Ezért, ha ismeretes, hogy az Ön IX-es faktor génjében ilyen mutációk vannak, akkor kezelőorvosa gondosabban figyelemmel kísérheti Önnél az allergiás reakció jeleit, főként, ha először kapja a BeneFIX-et.
- A IX-es faktorral szemben fellépő allergiás reakció veszélye miatt a BeneFIX első adagját olyan orvosi felügyelet mellett kell beadni, amely során biztosított az esetlegesen fellépő allergiás reakció megfelelő orvosi ellátása.
- A BeneFIX-ből nagyobb adagokra lehet szükség, mint más, a plazmából származó IX-es faktor készítményekből, amelyeket korábban kaphatott, még ha nincs is jelen IX-es faktor inhibitor. Ezért a plazma IX-es faktor aktivitásának szoros ellenőrzése (amely a vérének a véralvadási képességét méri) szükséges az adagolás megfelelő beállításához. Ha a javasolt adag nem szünteti meg a vérzést, forduljon kezelőorvosához.
- Ha máj- vagy szívbetegsége van, vagy ha a közelmúltban sebészi beavatkozáson esett át, úgy a véralvadási természetű szövődményeknek nagyobb a veszélye.
- Olyan, hemofília B-ben szenvedő, IX-es faktor inhibitorral rendelkező betegeknél, akiknek a kórelőzményében allergiás reakció szerepel, és akiknél nagy dózisú plazma eredetű IX-es faktort alkalmaztak immuntolerancia kiváltására, vesebetegség (nefrózis szindróma) kialakulásáról számoltak be.
- A klinikai vizsgálatokból még nem nyertek megfelelő mennyiségű adatot a korábban még nem kezelt (IX-es faktor infúziót korábban még soha nem kapott) betegek BeneFIX-szel történő kezeléséről.
- Javasolt, hogy a BeneFIX minden beadásakor jegyezze fel a készítmény nevét és a gyártási tétel számát. Az injekciós üvegen található egyik lehúzható cimkét felhasználhatja arra, hogy naplójában rögzítse a gyártási tétel számát, illetve bejelentsen valamely mellékhatást.
Egyéb gyógyszerek és a BeneFIX
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről.
Terhesség és szoptatás
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, csak kezelőorvosa kifejezett utasítására alkalmazza a BeneFIX-et. Nem ismert, hogy a BeneFIX károsítja-e a meg nem született gyermeket, ha terhes nőknél alkalmazzák. Kezelőorvosa javasolhatja a BeneFIX-szel való kezelés beszüntetését, ha Ön szoptat vagy teherbe esett.
Mielőtt elkezdeni alkalmazni ezt a gyógyszert, beszélje meg kezelőorvosával vagy gyógyszerészével.
A készítmény hatásai a gépjárművezetéshez és a gépek kezeléséhez szükséges képességekre
A BeneFIX nem befolyásolja az Ön gépjárművezetéshez és a gépek kezeléséhez szükséges képességeit.
A BeneFIX nátriumot tartalmaz
A BeneFIX készítmény feloldást követően 0,2 mmol (4,6 mg) nátriumot tartalmaz injekciós üvegenként, azaz gyakorlatilag "nátriummentes". Az Ön testtömegétől és BeneFIX adagjától függően több injekciós üvegnyi adagot is kaphat. Ezt figyelembe kell venni, ha alacsony sótartalmú étrendet követ.
3. Hogyan kell alkalmazni a BeneFIX-et?
A gyógyszert mindig a kezelőorvosa vagy gyógyszerésze által elmondottaknak megfelelően alkalmazza. Amennyiben nem biztos az adagolást illetően, kérdezze meg kezelőorvosát vagy gyógyszerészét.
Az alkalmazandó BeneFIX adagot kezelőorvosa fogja kijelölni. Ez az adag és az alkalmazás időtartama az Ön egyéni IX-es faktor igényétől és attól függ, hogy szervezete milyen gyorsan használja fel a IX-es faktort, amit rendszeres időközönként ellenőrizni fognak. Ha egy, a plazmából kivont IX-es faktor készítményről vált BeneFIX-re, észreveheti, hogy az Önnek adott adagok eltérőek lehetnek.
Kezelése alatt kezelőorvosa megváltoztathatja az alkalmazott BeneFIX adagját.
Feloldás és beadás
A BeneFIX feloldásával és beadásával kapcsolatos alább leírt lépések irányelvek. A betegeknek mindig a kezelőorvosuk által előírt, a készítmény intravénás beadására vonatkozó eljárást kell követniük.
A BeneFIX intravénás (iv.) infúzió formájában kerül beadásra a liofilizált injekcióhoz való pornak a mellékelt előretöltött fecskendőben lévő oldószerrel (nátrium-klorid (só) oldat) történt feloldása után.
Mindig mosson kezet, mielőtt az alábbi lépéseket végrehajtaná. A feloldás során aszeptikus (tiszta és csíramentes) eljárást kell alkalmazni.
Feloldás: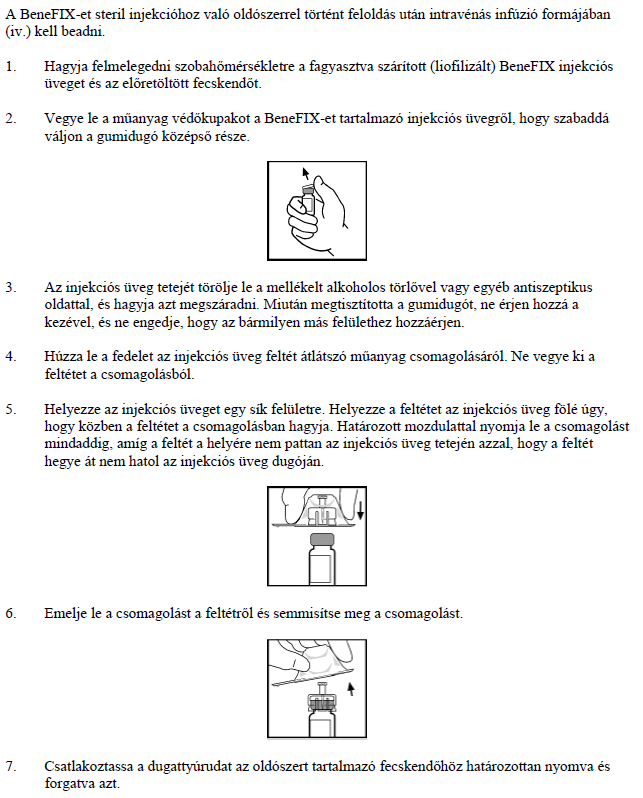
A BeneFIX-et a feloldás után azonnal, de legkésőbb 3 órán belül be kell adni. Az elkészített oldatot a beadás előtt szobahőmérsékleten lehet tárolni.
Beadás (intravénás injekció):
A BeneFIX-et a mellékelt oldószert tartalmazó előretöltött fecskendővel vagy bármely más egyszerhasználatos műanyag luer fecskendővel kell beadni. Továbbá az oldatot a injekciós üveg feltétet használva kell kiszívni az injekciós üvegből.
A legtöbb esetben a betegek a legfeljebb 4 ml/perces infúziós sebességet jól viselik. A BeneFIX-et vénába kell beinjekciózni néhány perc alatt. Kezelőorvosa módosíthatja az infúzió javasolt sebességét, hogy ne legyen olyan kellemetlen Önnek az infúzió beadása.
Irodalmi adatok vannak arról, hogy a vörösvértestek a fecskendőben, ill. a szerelékben a BeneFIX kezelés során összetapadhatnak (agglutináció). Ezzel a megfigyeléssel kapcsolatban nem jelentettek mellékhatást. A vörösvértestek összetapadása előfordulásának minimálisra csökkentése érdekében fontos, hogy minél kevesebb vér kerüljön a szerelékbe. A fecskendőbe nem kerülhet vér. Ha a fecskendőben, ill. a szerelékben a vörösvértestek összetapadása következne be, úgy minden anyagot (csöveket, fecskendőt és a BeneFIX oldatot) meg kell semmisíteni, egy új csomagolást kell bontani, és azt kell beadni.
Mivel a BeneFIX folyamatos infúzióban (cseppinfúzió) történő adását nem vizsgálták, a BeneFIX nem keverhető infúziós oldatokkal és nem adható cseppinfúzióban.
A fel nem használt oldatot, az üres injekciós üvegeket, elhasznált tűket és fecskendőket helyezze egy, a veszélyes hulladékok tárolására szolgáló tartóedénybe, és csak ezt követően semmisítse meg őket, mivel ezek az eszközök a gondatlan hulladékkezelés kapcsán másoknak sérülést okozhatnak.
Ha az előírtnál több BeneFIX-et alkalmazott
Azonnal keresse fel kezelőorvosát, ha több BeneFIX-et adott be, mint amennyit a kezelőorvosa előírt.
Ha idő előtt abbahagyja a BeneFIX alkalmazását
Ne hagyja abba a BeneFIX alkalmazását anélkül, hogy megbeszélte volna kezelőorvosával.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert.
4. Lehetséges mellékhatások
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
Túlérzékenységi/allergiás reakciók
A BeneFIX használatakor előfordulhatnak allergiás típusú túlérzékenységi reakciók. Ilyen reakciók lehetnek például a következők: az arc vagy a torok duzzanata, égő és szúró érzés az infúzió helyén, hidegrázás, kipirulás, viszketés, fejfájás, csalánkiütés, alacsony vérnyomás, levertség, émelygés, izgatottság, gyorsult szívverés, mellkasi szorító érzés, zsibbadás, hányás, sípoló légzés. Egyes esetekben az ilyen reakciók súlyos anafilaxiává fejlődtek. Az allergiás reakciók a IX-es faktor inhibitor kialakulásával szoros időbeni összefüggésben jelenhetnek meg (lásd még "Figyelmeztetések és óvintézkedések").
Ezek a reakciók potenciálisan életveszélyesek lehetnek. Ha allergiás/anafilaxiás reakciók lépnek fel, az infúzió adását azonnal függessze fel, és azonnal forduljon orvoshoz vagy vegye igénybe a sürgősségi betegellátást. A szükséges kezelés formája a mellékhatások természetétől és súlyosságától függ (lásd még "Figyelmeztetések és óvintézkedések").
Inhibitor kialakulása
A hemofília B-ben szenvedő betegeknél IX-es faktort semlegesítő ellenanyagok (inhibitorok) alakulhatnak ki. Ilyen inhibitorok előfordulásának jele lehet, hogy a vérzés kezeléséhez normális esetben szükséges BeneFIX mennyiség megnő és/vagy a kezelést követően folytatódik a vérzés. Ilyen esetekben javasolt a specializált hemofília-centrumokkal való kapcsolatfelvétel. Lehet, hogy kezelőorvosa az inhibitorok kialakulását ellenőrizni szeretné Önnél (lásd még "Figyelmeztetések és óvintézkedések").
Olyan, hemofília B-ben szenvedő, IX-es faktor inhibitorral rendelkező betegeknél, akiknek a kórelőzményében allergiás reakció szerepel, és akiknél nagy dózisú plazma eredetű IX-es faktort alkalmaztak immuntolerancia kiváltására, vesebetegség kialakulásáról számoltak be (lásd még "Figyelmeztetések és óvintézkedések").
Trombotikus események
Ha az Ön esetében olyan kockázati tényezők állnak fenn, melyek elősegítik a vérrögök kialakulását, pl. olyan tartós vénakanülje van, melyen keresztül a BeneFIX-et folyamatos infúzióban kapja, a BeneFIX növelheti Önnél a trombózis (kóros vérrögök kialakulása) kockázatát. A vérrögök kialakulásával kapcsolatban súlyos esetekről is beszámoltak, köztük olyan kritikus állapotú újszülötteknél kialakult vérrögökről, akik egy, közvetlenül a szívbe vezető vénába ültetett vénakanülön keresztül, folyamatos infúzióban kapták a BeneFIX-et. Perifériás visszérgyulladást (a vénák fájdalma és vörössége) és mélyvénás trombózist (vérrögök a végtagokban) szintén jelentettek. A legtöbb ilyen esetben a BeneFIX-et folyamatos infúzióban adták be, ami nem jóváhagyott módja az adagolásnak.
Nagyon gyakori mellékhatások (10 emberből több mint 1-nél jelentkezhet):
- Fejfájás
- Köhögés
- Láz
Gyakori mellékhatások (10 emberből legfeljebb 1-nél jelentkezhet):
- Túlérzékenységi/allergiás reakciók
- Szédülés, az ízérzés megváltozása
- A vénák fájdalma és gyulladása (flebitisz), kipirulás
- Hányás, émelygés
- Bőrkiütés, csalánkiütés
- Mellkasi kellemetlen érzés (beleértve a mellkasi szorító érzést)
- Helyi reakciók a beadás helyén (beleértve az infúzió helyén fellépő viszketést és a bőr kivörösödését), fájdalom és kellemetlen érzés az infúzió beadási helyén
Nem gyakori mellékhatások (100 emberből legfeljebb 1-nél jelentkezhet):
- Semlegesítő ellenanyag molekulák (inhibitorok) kialakulása
- A bőr fájdalma és kivörösödése (cellulitisz) az infúzió helyén
- Álmosság, reszketés
- Látáskárosodás (beleértve a homályos látást, valamint foltok/fények megjelenését a látótérben)
- Gyorsult szívverés, alacsony vérnyomás
- Veseinfarktus (a vese vérellátásának megszakadása)
Ismeretlen gyakoriságú mellékhatások (gyakoriságuk a rendelkezésre álló adatokból nem állapítható meg)
- Anafilaxiás reakció
- Trombotikus események (rendellenes vérrögök)
- A kezelés sikertelensége (nem sikerül leállítani vagy megelőzni a vérzéseket)
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti a https://mellekhatas.ogyei.gov.hu/ weboldalon.
A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságos alkalmazásával kapcsolatban.
5. Hogyan kell a BeneFIX-et tárolni?
A gyógyszer gyermekektől elzárva tartandó!
A dobozon és az injekciós üveg címkén feltüntetett lejárati idő után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
A BeneFIX-et 30 °C alatt tárolandó, és a címkén feltüntetett lejárati idő előtt fel kell használni.
Az előretöltött fecskendő károsodásának elkerülése érdekében nem fagyasztható!
Az elkészített oldat azonnal, de legkésőbb a feloldást követő 3 órán belül felhasználandó.
Ne alkalmazza a BeneFIX-et, ha az oldat nem átlátszó és színtelen.
Oldat elkészítésére csak a dobozban mellékelt előretöltött fecskendőket használja. A beadáshoz más steril egyszerhasználatos fecskendők is használhatók.
Semmilyen gyógyszet ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ezek az intézkedések elősegítik a környezet védelmét.
6. A csomagolás tartalma és egyéb információk
Mit tartalmaz a BeneFIX?
- A készítmény hatóanyaga az alfa-nonakog (rekombináns IX-es alvadási faktor). Minden BeneFIX injekciós üveg névlegesen 250, 500, 1000, 1500, 2000 vagy 3000 NE alfa-nonakogot tartalmaz.
- Egyéb összetevők: szacharóz, glicin, L-hisztidin, poliszorbát 80. A feloldáshoz szükséges oldószer (0,234%-os nátrium-klorid oldat) szintén mellékelve van.
- A mellékelt oldószerrel (0,234%-os nátrium-klorid oldat) történt feloldás után minden injekciós üveg 50, 100, 200, 300, 400 vagy 600 NE/ml alfa-nonakogot tartalmaz (lásd 1. táblázat).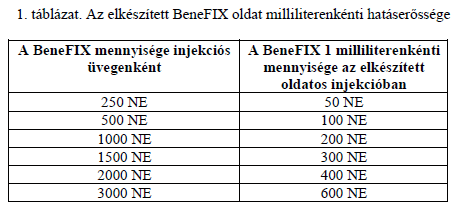
Milyen a BeneFIX külleme és mit tartalmaz a csomagolás?
A BeneFIX injekcióhoz való por formájában, injekciós üvegben, az oldószer előretöltött fecskendőben kerül forgalomba.
A csomagolás a következőket tartalmazza:
- egy injekciós üveg BeneFIX 250, 500, 1000, 1500, 2000 vagy 3000 NE por
- egy oldószert tartalmazó, egy dugattyúrúddal ellátott előretöltött fecskendő, 5 ml steril injekcióhoz való 0,234%-os nátriumklorid oldattal a feloldáshoz
- egy, a feloldáshoz használatos eszköz, steril injekciós üveg feltét
- egy steril infúziós szerelék
- két alkoholos törlőkendő
- egy tapasz
- egy gézlap
A szöveg publikálásának dátuma az ema.europa.eu weboldalon: 2022.10.17.
 Nem áll rendelkezésre kép
Nem áll rendelkezésre kép Hatóanyag:
nonacog alfa
Normatív TB-támogatás:
Eü. emelt támogatás:
Gyártó:
Pfizer Europe
Ár:
479071 Ft A feltüntetett ár tájékoztató jellegű
Kategóriák
ACNE-ELLENES KÉSZÍTMÉNYEK
ANTIBIOTICUMOK ÉS CHEMOTHERAPEUTICUMOK BŐRGYÓGYÁSZATI HASZNÁLATRA
ANTISEPTICUMOK ÉS FERTŐTLENÍTŐK
BŐRLÁGYÍTÓ- ÉS VÉDŐANYAGOK
CORTICOSTEROIDOK, BŐRGYÓGYÁSZATI KÉSZÍTMÉNYEK
EGYÉB BŐRGYÓGYÁSZATI KÉSZÍTMÉNYEK
GOMBÁSODÁS ELLENI BŐRGYÓGYÁSZATI SZEREK
GYÓGYSZERTARTALMÚ KÖTSZEREK
PSORIASIS ELLENI SZEREK
SEBEK ÉS FEKÉLYEK KEZELÉSÉRE SZOLGÁLÓ KÉSZÍTMÉNYEK
VISZKETÉS ELLENI SZEREK, BELEÉRTVE ANTIHISTAMINOK, ÉRZÉSTELENÍTŐK, STB.
ANTIDIABETIKUS TERÁPIA
ÁSVÁNYI ANYAGOK
DIGESTIVUMOK, BELEÉRTVE AZ ENZIMKÉSZÍTMÉNYEKET
ELHÍZÁS ELLENI SZEREK A DIÉTÁS KÉSZÍTMÉNYEK KIVÉTELÉVEL
EPE- ÉS MÁJBETEGSÉGEK GYÓGYSZEREI
ÉTVÁGYGERJESZTŐK
FOGÁSZATI KÉSZÍTMÉNYEK
FUNKCIONÁLIS GASTROINTESTINALIS BETEGSÉGEK ELLENI SZEREK
HÁNYÁSCSILLAPÍTÓK ÉS ÉMELYGÉS ELLENI SZEREK
HASMENÉSGÁTLÓK, VALAMINT A BÉL GYULLADÁSOS ÉS FERTŐZÉSES MEGBETEGEDÉSEINEK SZEREI
ROBORÁLÓ SZEREK
SAVTERMELÉS ZAVARÁVAL JÁRÓ BETEGSÉGEK GYÓGYSZEREI
SYSTEMÁS ANABOLICUMOK
SZÉKREKEDÉS ELLENI SZEREK
TÁPCSATORNA ÉS ANYAGCSERE EGYÉB GYÓGYSZEREI
VITAMINOK

Az adatokat a PHARMINDEX gyógyszer-információs adatbázis szolgáltatja
Ⓒ Vidal Next kft. 2026.